中华医学会外科学分会结直肠外科学组
中华医学会外科学分会营养支持学组
中国医师协会外科医师分会结直肠外科医师委员会
【关键词】结直肠癌;围手术期;营养治疗;多学科综合治疗协作组
2018 年世界卫生组织发布的全球肿瘤报告“Global Cancer Statistics 2018”显示,全球新发癌症病例1810万例,其中结直肠癌(colorectal cancer,CRC)发病率占10.2%,居第3位。2018年中国国家癌症中心发布的全国癌症统计数据显示,我国CRC每年发病约37万例,发病率占恶性肿瘤的第3位。50%CRC病人可出现体重丢失,20%出现营养不良。营养不良导致CRC病人错过最佳手术时机,降低辅助治疗效果,延长住院时间,增加病人经济负担,并导致病人并发症发生率和病死率上升。CRC病人的营养治疗已成为其多学科综合治疗的重要组成部分。合理、有效地提供营养治疗对改善CRC病人的预后及生活质量具有重要作用。
为了更好地规范我国CRC病人的临床营养治疗,中华医学会外科学分会结直肠外科学组、营养支持学组及中国医师协会外科医师分会结直肠外科医师委员会组织国内部分专家,参考近年来国内外发表的文献及中国和国际营养相关学术组织的指南和专家共识,综合我国专家意见,最终形成本共识。
1 CRC 病人的全程营养管理
营养摄入不足与癌症病人的体重减轻有关;肌肉蛋白质的丢失是癌症恶液质的主要特征,并严重影响病人的生活质量以及对治疗的耐受性;肿瘤病人常存在全身炎性反应综合征,并不同程度地影响蛋白质、碳水化合物和脂类的代谢。CRC 常引起营养不良,反之营养不良会影响CRC的手术、放化疗等多学科综合治疗效果,并增加并发症发生率,影响病人整体康复与预后。2015年美国外科医师协会与国家外科质量改善项目(ACS-NSQIP)报道一项大型多中心研究,CRC病人术后病死率与术前低白蛋白血症、低体重和体重指数(BMI)<18.5显著相关,仅低白蛋白血症一项即可预测术后并发症。
营养治疗在CRC病人整个治疗过程中发挥着重要作用。对于拟接受手术、放化疗等治疗的病人,充足的营养治疗被证实可以通过增加病人对治疗的耐受性和减少并发症来改善病人短期结局,加速康复时间,并有助于改善病人的生活质量。鉴于营养治疗对肿瘤病人生活质量的积极作用,营养治疗应该贯穿于肿瘤治疗的全过程(图1)。
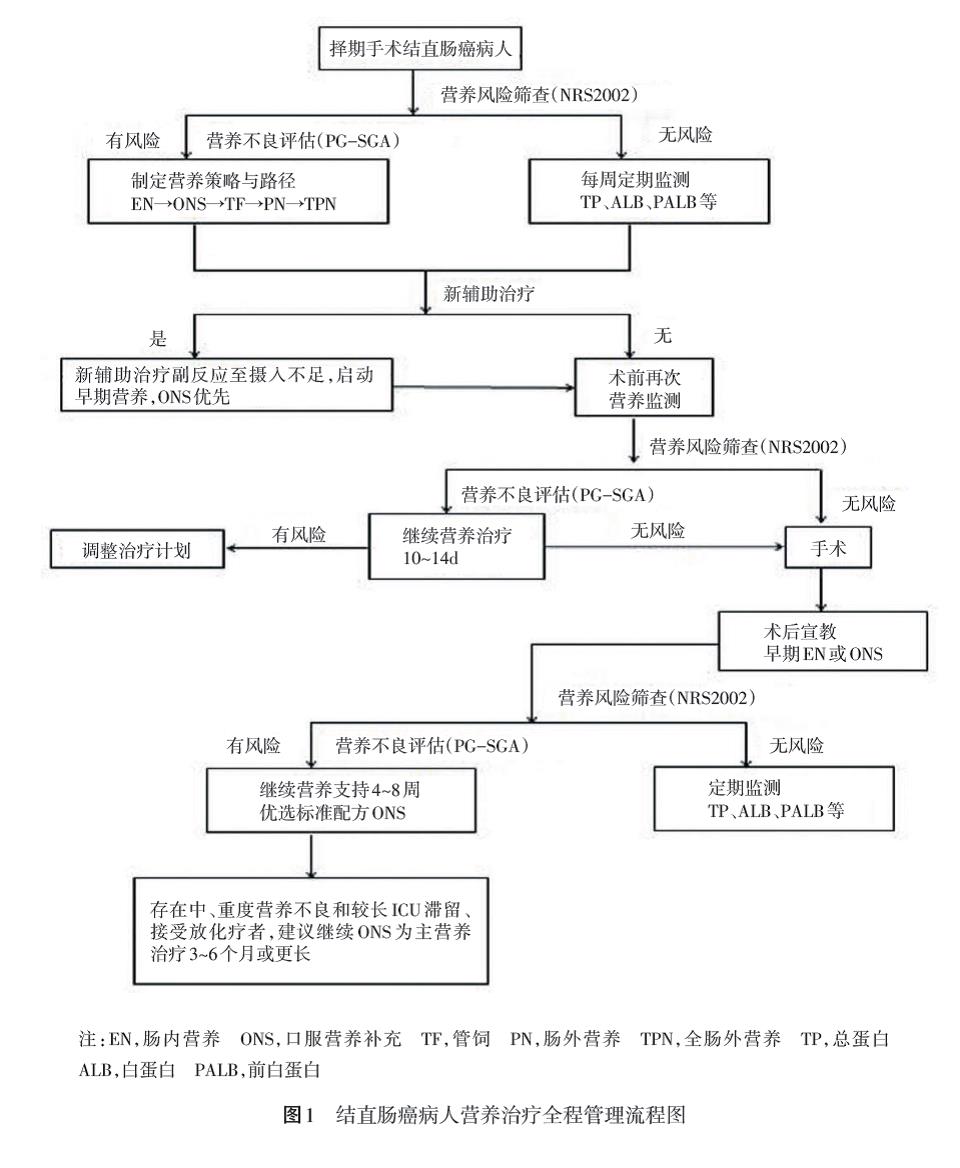
建议:CRC病人的治疗应实施多学科综合治疗协作组(multiple disciplinary team,MDT)模式,除手术外还可能涉及新辅助放化疗、辅助放化疗、生物治疗和靶向治疗等。营养治疗应贯穿于从首诊到完成整个综合治疗的全过程。
2 CRC 病人营养风险筛查和营养不良评估
CRC病人实施规范化营养治疗首先要筛查营养风险,进而准确评估营养状况,并及时给予营养治疗。2003年欧洲肠外肠内营养学会(ESPEN)颁布的《营养风险筛查指南》指出,营养风险筛查2002(nutritional risk screening 2002,NRS2002)评分是基于128项循证医学结果得出的营养风险筛查工具,对NRS2002评分≥3分的胃肠手术病人和肿瘤病人进行营养状况评估,对术前制定合理的营养治疗方案和术后临床结局的预测均具有良好的指导意义。中华医学会肠外肠内营养学分会(CSPEN)开展的研究显示,结合我国BMI标准,NRS2002评分适用于99%以上的中国住院病人。
对于营养不良的评估,目前常用的评估工具包括病人自评主观全面评定量表(patient-generated subjective global assessment,PG-SGA)、主观全面评定量表(subjective global assessment,SGA)、微型营养评定量表(mini nutritional as⁃Keywords colorectal cancer;perioperative period;nutritional therapy;multiple disciplinary team sessment,MNA)和营养不良通用筛查工具(malnutrition uni⁃versal screening tools,MUST)。对于营养不良的诊断,如果存在营养风险,然后符合下列两条之一即可诊断为营养不良:(1)BMI<18.5。(2)体重丢失(>10%,或3 个月内下降>5%)+BMI减少(<70岁者BMI<20,或≥70岁者BMI<22)。2018年美国加速康复协会(ASER)推荐的PONS工具采用了类似的标准。临床研究显示,PG-SGA是一种有效的肿瘤病人特异性营养状况评估工具,可以快速识别营养不良的肿瘤病人并对其进行适当的营养干预。
建议:CRC病人一经确诊,即应进行营养风险筛查及营养状况评估,并贯穿于CRC病人治疗全过程。
建议:对于CRC病人的营养风险筛查,推荐采用营养风险筛查NRS2002评分工具,评分≥3分者为具有营养风险。建议采用PG-SGA方法进行病人营养状态的评估,以制定基于个体化的营养治疗计划。NRS2002评分无营养风险者,建议住院期间每周筛查1次。
3 CRC 病人营养支持的基本原则
CRC病人营养治疗的适应证:基于国内外最新的指南推荐,建议NRS2002营养风险评分≥3分,或者存在营养不良病人;或者依据临床实际食物摄入情况,例如病人1周未进食,或1~2周内的能量摄入<60%总需求量,对于这些CRC病人均应立即启动营养治疗。推荐按照间接测热法实际测量机体静息能量消耗值提供CRC病人的能量目标需要量,无条件测定时可按照104.5~125.4 kJ/(kg·d)[25~30 kcal/(kg·d)]提供。CRC病人蛋白质目标需要量为1.0~1.5 g/(kg·d)。提高CRC病人膳食和营养治疗配方中脂肪供能的比例,增加膳食能量密度。补充生理需要量的维生素及微量元素。
消化道有功能的病人应首先选用肠内营养(enteral nu⁃trition,EN)。依据胃肠道的功能,可以选择口服营养补充剂(oral nutritional supplements,ONS)和(或)管饲(enteral tube feeding,ETF),如果单用ONS或ETF>7 d仍未达到病人能量目标需要量,则建议加用肠外营养(parenteral nutrition,PN)。而完全肠外营养(TPN)治疗仅适用于完全性肠梗阻、严重吻合口漏、肠功能衰竭等具有EN绝对禁忌证的病人。
PN 输注途径可分为外周静脉置管(peripheral venous catheter,PVC)和中心静脉置管(central venous catheter,CVC)。临床上选择PN输注途径时须考虑输注营养液的渗透压、预计的输注时间、有无静脉置管病史、拟穿刺部位血管解剖条件、病人凝血功能、合并疾病情况、是否存在病理性体位、护理人员的导管维护技能及病人对静脉置管的主观感受和知情同意等。中心静脉置管又分为经外周置入中心静脉导管(peripherally inserted central catheter,PICC)、经皮穿刺中心静脉置管(暂时性中心静脉置管)和静脉输液港(永久性中心静脉导管)等。预计PN 治疗>14 d者,推荐行CVC途径。外周PN适用于接受较低渗透浓度制剂(通常建议≤900 mOsm/L,pH 值>5.2)的短期治疗。
基于加速康复外科(enhanced recovery after surgery,ERAS)在结直肠外科临床实践中的成功应用,实施ERAS有助于提高CRC病人围手术期的安全性及满意度,可减少30%的术后住院时间,从而减少医疗支出,并不增加术后并发症发生率及再住院率。
建议:对于CRC病人,NRS2002营养风险评分≥3分或者存在PG-SGA营养不良评分≥4分,须进行营养治疗。
建议:预计CRC病人不能进食>7 d,或无法摄入60%以上能量目标需要量>1~2周时,应立即启动营养治疗。
建议:CRC 病人营养途径应依据胃肠道功能状态选择。首选EN 补充,当ONS 不能满足营养需求时,可选择ETF,当EN无法实施或不能满足营养需求时应选择补充性肠外营养(SPN)或TPN。
建议:PN途径应该根据PN制剂类型、治疗时间和感染风险进行选择。
建议:CRC病人无论接受根治手术还是姑息手术,均应按照ERAS原则和流程实施围手术期的营养管理。
4 CRC 病人围手术期营养治疗策略
早期启动术前营养治疗能带给病人诸多的益处,EN治疗可以减少手术治疗的各种并发症,包括降低吻合口漏的发生率、减少切口部位感染(surgical sites infection,SSI)、减少住院时间、促进吻合口愈合、提高病人生活质量和及早适应进一步的放化疗。Lewis等对11篇比较肠切除术后早期进食与常规禁食的RCT文献进行Meta分析发现,早期进食可显著降低各种类型的感染性并发症发生率,缩短住院时间。有研究将接受手术的CRC病人随机分为试验组(接受围手术期EN治疗)和对照组(传统治疗),发现试验组病人术前肠道准备不良发生率、平均清肠排便次数、术前口渴发生率、术前饥饿发生率均较对照组明显降低,而且术后首次排气排便时间、术后住院时间均短于对照组。
术后早期启动EN治疗可以减少手术治疗的各种并发症。Pan等在一项多中心前瞻性队列研究中发现,营养治疗是高营养风险癌症病人的一种保护性因素,减少了大约66%的不良事件的风险。Chen等研究发现NRS2002筛查无风险术后接受营养治疗的CRC病人并发症发生率更高,术后住院时间更长,以及花费更多。Boelens等研究发现,CRC病人术后早期给予EN比PN具有更好的术后结果,EN组排气时间更早,吻合口漏发生率降低,平均住院时间缩短。
术后早期进食EN制剂可以根据病人的肠功能恢复情况,从低浓度、小剂量逐渐增加,以提升病人的耐受性。对于大多数病人,术后早期使用整蛋白的标准EN制剂是合适的,但仍应考虑病人的肠功能恢复情况,必要时从1/2~1/3标准的低浓度、每日300~500 mL的小剂量开始,然后逐渐增加,使病人能够更好地耐受。
建议:对于术前存在高营养风险或营养不良病人,应给予10~14 d或更长时间营养治疗,首选EN。如果EN不能满足病人的能量需求,建议术前给予PN治疗。
建议:术前推荐口服含碳水化合物的饮品,通常是在术前10 h给予病人800 mL,直至术前2 h。术前总蛋白/氨基酸摄入达标比总能量摄入达标更重要,建议蛋白/氨基酸摄入达到1.0~1.5 g/(kg·d)。
建议:CRC病人术后的营养治疗首选ONS,建议于手术当日即可配合流食开始ONS营养治疗。对于并发肠梗阻或吻合口漏病人,推荐给予PN治疗。
建议:对于CRC病人术后存在营养不良者,建议出院后继续接受4~8周营养治疗,推荐使用标准配方的ONS。
建议:对于术后中、重度营养不良病人、较长ICU滞留时间的病人,以及术后进行辅助放化疗的病人,建议出院后继续给予以ONS为主营养治疗,时间可达3~6个月或更长。
5 CRC 病人放化疗的营养治疗策略
5.1 CRC病人化疗化疗常见的不良反应为胃肠道的毒性,导致黏膜炎、口腔干燥、恶心呕吐、腹泻和营养不良。不仅影响病人的生活质量,而且使病人不易接受放、化疗和降低放、化疗的疗效。胃肠道的不良反应导致病人营养状态恶化、生活质量下降以及免疫功能受损。严重毒性反应常导致化疗中断,或化疗延迟,或减少总体化疗时间。化疗前营养不良与剂量有关的化疗毒性增加相关,与病人整体情况恶化、生活质量受损、生存期缩短相关,影响病人对化疗的耐受性。化疗期间给予营养治疗,能够改善病人的营养状态,提高病人对化疗的耐受性,减轻化疗的毒性反应,延长病人的DFS和OS时间。
建议:对于实施术前新辅助化疗,或术后辅助化疗的CRC病人,需要制定营养治疗计划和进行营养治疗。
建议:化疗前进行营养治疗有助于CRC病人维持体重和减轻化疗导致恶心、呕吐等消化道副反应,早期营养补充建议在化疗开始2周内给予。
5.2 CRC病人放疗 腹部放疗可通过直接和间接的方式损伤肠道黏膜屏障功能,导致恶心、呕吐、痉挛性腹痛、发热和腹泻等症状,影响营养素的摄入、消化及吸收,部分病人产生慢性放射性肠炎,发生慢性肠梗阻或肠瘘等并发症。
EN治疗对CRC病人放疗具有增效减毒作用。Ravasco等在研究放疗CRC病人时发现,给予营养指导和营养治疗,可以改善病人的营养状态、降低疾病引起的并发症发生率和提高病人的生活质量。一项纳入111例接受放疗的CRC病人的RCT结果显示,放疗前3个月内进行营养支持的病人比未行营养支持者能量和蛋白摄入得到改善,以及放疗期间生活质量得到改善。
EN可加速因放疗受损的胃肠道黏膜的修复,有助于维护肠黏膜屏障、防止肠道细菌易位和肠源性感染。放疗病人的营养治疗首选EN。在放疗期间口服营养补充有助于放疗前维持体重和减轻放疗导致的肠黏膜损伤,也有助于保证放疗中病人达到足够营养摄入量和放疗后病人营养状况的维持。
建议:对于实施术前新辅助放疗,或术后辅助放疗的CRC病人,需要制定营养治疗计划和进行营养治疗。
建议:放疗前进行营养治疗有助于病人维持体重和减轻放疗导致黏膜损伤。早期营养补充在放疗前或放疗开始的2周内给予。
6 特殊营养制剂对CRC 病人临床应用价值
6.1 ω-3多不饱和脂肪酸(PUFA) 目前关于ω-3 PUFA能否显著改善CRC病人术后免疫功能、营养状态、生活质量和远期预后尚无一致结论。关于ω-3 PUFA对放化疗和PN治疗病人短期结局的影响,也无一致结论。
建议:CRC病人的围手术期营养治疗不推荐常规补充ω-3 PUFA。
6.2 谷氨酰胺(Gln) 目前关于Gln 对CRC 病人围手术期、放化疗、抗肿瘤和预后的影响,相关研究较少,无一致结论。
建议:CRC 病人围手术期营养治疗不推荐常规补充Gln。
7 CRC 合并肠梗阻的营养治疗策略
对于CRC合并肠梗阻病人,应尽快恢复酸碱平衡和纠正水电解质紊乱,补充血容量,消除贫血和低蛋白血症,积极预防休克。给予胃肠减压和抗生素治疗。病人未进食8~12 h 之后,体内糖原将耗尽,应适当输注含糖晶体液(50~100 g/d),以减少饥饿性酮症,争取在48 h内使体液状态达到平衡和稳定。有条件者可以使用自膨性金属支架(SEMS),暂时疏通肠道,缓解梗阻症状,并为术前实施EN治疗及安全Ⅰ期切除吻合创造条件。
对紧急手术或预定48 h内手术的肠梗阻病人,不推荐术前营养治疗。对非手术治疗和拟实施一段术前准备的病人,一般在补液后48 h开始实施PN治疗,以改善病人的营养状态。未经补液即行PN治疗者,易出现低钾血症。对于长期非手术治疗病人,要询问其补液或PN史、检测其血电解质、磷和维生素水平,以防发生再喂食综合征(refeeding syndrome)。
建议:营养治疗有利于改善CRC病人合并肠梗阻导致的病理生理紊乱。PN为CRC合并肠梗阻病人首选营养治疗途径。
建议:SEMS是可切除CRC合并肠梗阻病人急诊手术转为限期手术的桥梁,也是PN 治疗向EN 治疗转化的前提。
《结直肠癌围手术期营养治疗中国专家共识(2019版)》编审委员会成员名单
主任委员:张忠涛,李宁,叶颖江
成员(按姓氏汉语拼音排序):陈凛,戴勇,董明,杜晓辉,冯勇,顾晋,韩方海,韩加刚,江志伟,李宁,林锋,林国乐,林建江,刘骞,彭俊生,钱群,田利国,童卫东,王振军,王自强,武爱文,肖刚,肖毅,熊志国,姚宏伟,叶颖江,张卫,张忠涛,周建平,朱维铭
执笔者:董明,周建平,姚宏伟
参考文献:略
文章来源:中国实用外科杂志2019年6 月第39 卷第6 期
www.ahyllaw.com、安徽医疗纠纷律师、合肥医疗纠纷律师、安徽医疗事故律师、合肥医疗事故律师、安徽医疗律师、合肥医疗律师、医疗事故律师、医疗纠纷律师、陈俊福律师


