中华医学会器官移植学分会
【摘要】 为了进一步规范器官移植免疫抑制剂的临床应用,中华医学会器官移植学分会组织全国31 家移植中心的器官移植专家,从器官移植免疫诱导药物应用技术规范、器官移植维持期免疫抑制剂应用技术规范、器官移植常用免疫抑制方案技术规范、器官移植免疫抑制剂血药浓度监测技术规范、器官移植药物性肝肾损伤治疗技术规范等方面,制订本规范,以帮助器官移植工作者规范和优化器官移植免疫抑制剂的临床应用。
【关键词】 器官移植;免疫抑制剂;免疫诱导;钙神经蛋白抑制剂;环孢素;他克莫司;抗细胞增殖类药物;硫唑嘌呤;吗替麦考酚酯;麦考酚钠肠溶片;咪唑立宾;哺乳动物雷帕霉素靶蛋白抑制剂;西罗莫司;糖皮质激素
器官移植是迄今治疗终末期器官功能衰竭最为理想的手段。如何提高移植物和移植受者的长期存活率是移植学研究的主要课题,其中,对于免疫抑制剂的研究占据着重要的地位,而免疫抑制剂又是一把“双刃剑”,一面是其抗排斥反应疗效,另一面则是其不良反应,为了更加科学合理地应用免疫抑制剂,全国31 家移植中心经过认真讨论制定了本规范。
免疫抑制剂是一类对机体的免疫反应具有抑制作用的药物,能抑制与免疫反应相关细胞(主要是T 细胞和B 细胞)的增殖和功能,降低免疫应答。由于各种免疫抑制剂的作用机制不同且其不良反应的程度多与使用剂量有关,因此,针对移植排斥反应发生的不同靶点和关键步骤常采用多种免疫抑制剂联合的方案,这样既可协同增强免疫抑制效果,又可降低各种免疫抑制剂的剂量和不良反应的发生率。合理的免疫抑制方案是最大程度发挥其抗排斥反应作用的同时减少其不良反应,保障移植受者长期高质量生存的重要基础。
目前临床应用的免疫抑制剂分为免疫诱导药物和维持治疗药物两类,常用的免疫抑制剂及其作用环节见图1。
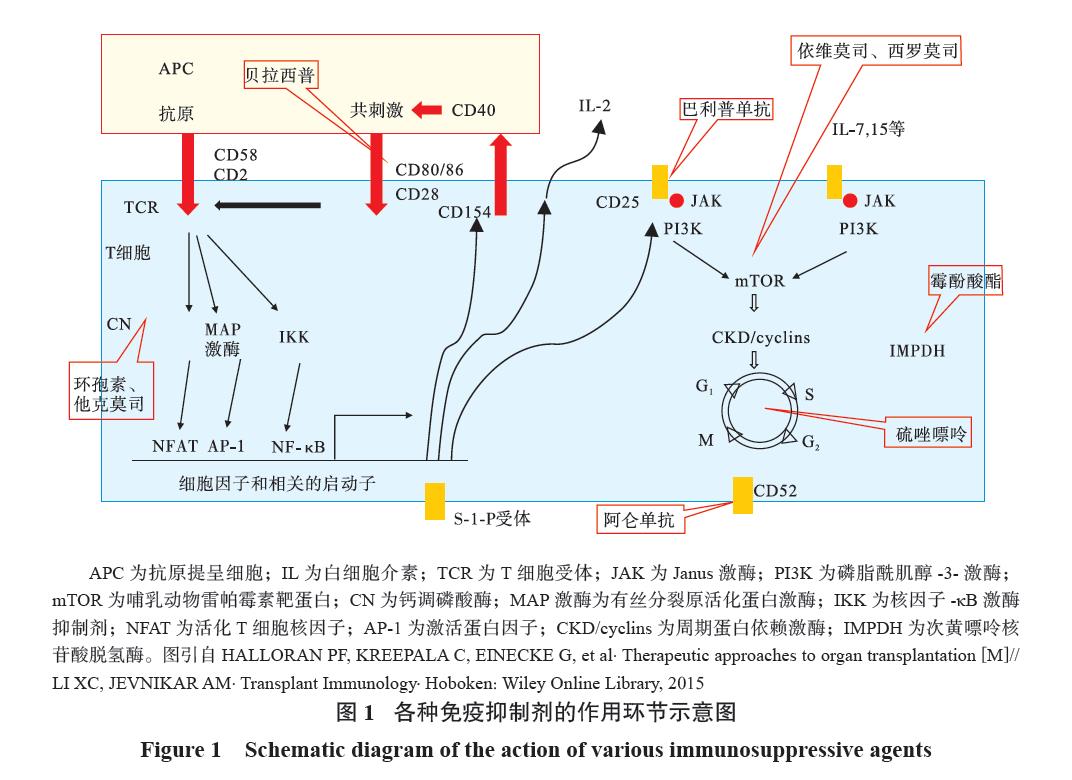
一、器官移植免疫诱导药物应用技术规范
排斥反应是影响同种异体器官移植术后移植器官长期存活的独立危险因素,移植后早期发生急性排斥反应的风险较高,而免疫诱导治疗的目的就是针对这一关键时期提供高强度的免疫抑制,从而有效减少急性排斥反应的发生,提高移植手术成功率。诱导的开始时间通常是在术前或术中,术后数日内结束。诱导治疗并非受者免疫抑制治疗必不可少的部分,依据器官移植的种类而有所不同。临床药理学上将诱导治疗用药分为两类:即多克隆抗体和单克隆抗体。
1 多克隆抗体
多克隆抗体是将不同来源的人类淋巴细胞作为免疫原,致敏鼠、兔、猪或马等动物,激活其B 淋巴细胞分泌特异性抗体(免疫球蛋白)后,采集并纯化这些抗体而制成。目前临床应用的多克隆抗体有两类:抗胸腺细胞球蛋白(antithymocyte globulin,ATG)和抗人T 细胞免疫球蛋白(anti-human T lymphocyte immunoglobulin,ALG),前者有兔抗人胸腺细胞免疫球蛋白(rATG),后者有兔抗人T 细胞免疫球蛋白(ALG-F),国内产品有猪抗人T 细胞免疫球蛋白。
1.1 作用机制
多克隆抗体是作用于T 淋巴细胞的选择性免疫抑制剂,基本机制是致使T 淋巴细胞耗竭。抗体与淋巴细胞结合后在补体协助下对后者产生细胞溶解作用,再由单核细胞和吞噬细胞作用形成的Fc- 依赖性调理素机制从循环中清除,消除时间约6 h。
1.2 临床应用
1.2.1 适应证 (1)预防急性排斥反应的诱导治疗;(2)激素抵抗性急性排斥反应治疗;(3)活组织检查(活检)证实为急性血管性排斥反应(Banff 2 级或3 级);(4)怀疑排斥反应引起的血清肌酐迅速升高或无尿;(5)在移植物功能延迟恢复(delayed graft function,DGF)时应用可以减少钙神经蛋白抑制剂(calcineurin inhibitor,CNI)类药物的剂量,减轻CNI 对移植肾的不良反应,预防急性排斥反应,缩短移植肾功能恢复的时间。
1.2.2 用法用量 (1)以rATG 为例,预防排斥反应的剂量为0.04~1.50 mg/(kg·d),治疗急性排斥反应的剂量为1.5~3.0 mg/(kg·d),稀释后经外周静脉滴注,时间在6 h 以上,疗程3~7 d;(2)每日给药或间隔给药对T 细胞抑制作用相似,均能达到有效的免疫抑制作用;(3)可通过监测移植受者血液循环中T 淋巴细胞的数量来调节剂量,以控制在外周血中CD3+ 细胞(成熟T 淋巴细胞)占淋巴细胞比例<10%为宜,与固定剂量方案相比,基于CD3+ 的监测进行剂量调整在一定程度上可以降低药物的成本。
1.2.3 禁忌证 既往使用同类制剂发生严重的全身性过敏反应、存在严重感染者。
1.3 不良反应
(1)ATG、ALG 均为异种血清产品,具有强烈的抗原性,可能会引起不同程度的过敏反应,故使用前要询问既往过敏史,根据说明书注射前需预防性应用抗组胺药物、退热药及糖皮质激素,使用期间以及停药两周内均应进行密切观察,某些不良反应可能与滴速过快有关;(2)白细胞减少和血小板减少较常见,治疗结束后应继续观察2 周血细胞计数;(3)使用多克隆抗体可能会增加巨细胞病毒感染的发生率;(4)反复多次应用可增加淋巴组织增生性疾病和恶性肿瘤的发生率。
2 单克隆抗体
单克隆抗体是由单一B 淋巴细胞克隆产生的高度均一、仅针对某一特定抗原表位的具有高度特异性的抗体。目前临床应用的白细胞介素-2 受体拮抗剂(interleukin-2 receptor antagonists, IL-2RA) 是T 细胞活化第3 信号的阻滞剂,国内常用药物为巴利昔单抗。
2.1 作用机制
IL-2RA 是一种人鼠嵌合的、针对IL-2 受体的α 链(CD25)的IgG1 单克隆抗体。其以高亲和力、特异性竞争性封闭限制IL-2 受体,阻断T 细胞活化的第2 信号,使T 细胞分化停滞在G0 期或G1 期而不能进入S 期,随之发生凋亡,从而抑制急性排斥反应。
2.2 临床应用
2.2.1 适应证 IL-2RA 用于排斥反应的预防。
2.2.2 用法用量 以巴利昔单抗为例,标准总剂量为40 mg,分两次给予,每次20 mg,首次应于移植术前2 h 内给予,第2 次于术后第4 日给予。经配制后的巴利昔单抗可一次性静脉注射,亦可在20~30 min内静脉滴注。如果术后出现对巴利昔单抗严重的过敏反应或移植物丢失等,则应停止第2 次给药。
2.2.3 禁忌证 对巴利昔单抗或处方中其它任何成分过敏者均禁用。
2.3 不良反应
IL-2RA 不良反应较少。少见的不良反应包括发热、乏力、头痛、胸痛、咳嗽、呼吸急促、心率加快、血压升高、血糖升高、恶心、呕吐、便秘、腹泻、皮肤切口愈合缓慢等。用药前和用药期间需监测血糖,血常规,肝、肾功能和生命体征。未见细胞因子释放综合征,故不必使用糖皮质激素预防。妊娠期、哺乳期妇女慎用。
二、器官移植维持期免疫抑制剂应用技术规范
器官移植维持期免疫抑制剂的应用是预防急性排斥反应,在预防排斥反应与免疫抑制剂逐步减少剂量方面获取平衡,以获得受者和移植物的长期存活。目前常用的药物有4 类:(1)CNI, 包括环孢素(ciclosporin,CsA)和他克莫司(tacrolimus,FK506);(2) 抗细胞增殖类药物, 包括硫唑嘌呤(azathioprine,AZA)、吗替麦考酚酯(mycophenolate mofetil,MMF)、麦考酚钠肠溶片(enteric-coated mycophenolate sodium,EC-MPS)、咪唑立宾(mizoribine,MZR)和来氟米特(leflunomide,LEF);(3) 哺乳动物雷帕霉素靶蛋白抑制剂(mammalian target of rapamycin inhibitor,mTORi):西罗莫司(sirolimus,SRL);(4)糖皮质激素。
1 环孢素
CsA 是第1 种CNI 制剂,1983 年美国食品与药品监督管理局(Food and Drug Administration,FDA)批准上市,从此器官移植领域正式进入“CsA时代”,1995 年采用微乳化技术进一步改善了药代动力学特性和提高了临床疗效。
1.1 作用机制
CsA 主要通过选择性抑制T 淋巴细胞活化而发挥免疫抑制作用。主要机制如下:(1)抑制淋巴细胞在抗原或分裂原刺激下的分化、增殖,阻断淋巴细胞生长周期使其停滞在G0 期或G1 期,使白细胞介素(interleukin,IL)-2、干扰素(interferon,IFN)-γ分泌抑制;(2)选择性作用于B 淋巴细胞的某些亚群;(3)不仅阻断巨噬细胞中lL-2 的释放,使其与细胞毒T 淋巴细胞(cytotoxic T lymphocyte,CTL)的活力完全抑制,还通过抑制T 淋巴细胞和促炎因子进而影响巨噬细胞产生和释放IL-1。
1.2 用法用量
(1)CsA 与其他免疫抑制剂合用时,口服用药起始量通常为3~6 mg/(kg·d),分2 次服用,每12 h口服1 次,根据受者免疫状态及血药浓度变化调整剂量,具体用量与CsA 剂型及免疫抑制方案有关;(2)CsA 可出现于母乳中,故接受本药治疗的母亲不应哺乳,CsA 在动物实验中无致畸作用,但在孕妇中使用的经验仍有限;(3)当CsA 与有肾毒性的药物如氨基苷类、两性霉素B、环丙沙星、美法仑及甲氧苄啶等合用时,会增加CsA 的肾毒性,应严密监测肾功能。
1.3 药物相互作用
已知可以提高CsA 血药浓度的药物有:抗真菌类药物(如酮康唑、氟康唑、伏立康唑和伊曲康唑等)、某些大环内酯类抗生素(如红霉素、阿奇霉素、交沙霉素和克拉霉素等)、某些钙通道阻滞药(如地尔硫䓬、尼卡地平和维拉帕米等)、多西环素、口服避孕药、五酯胶囊等。
已知可以降低CsA 血药浓度的药物有:抗结核药(如利福平、异烟肼等)、巴比妥酸盐、卡马西平、奥卡西平、苯妥英钠、安乃近、奥曲肽、萘夫西林钠、磺胺二甲嘧啶静脉注射剂(非口服剂)和甲氧苄啶等药物。
1.4 药物不良反应
(1)约1/3 的患者可出现与剂量相关的肾功能损伤,可致血清肌酐增高,肾小球滤过率下降等,慢性、进行性肾毒性多发生于CsA 治疗后12 个月;(2)较常见的不良反应包括肝毒性及神经毒性;(3)高钾血症;(4)部分服用者有厌食、恶心、呕吐等胃肠道反应及多毛、牙龈增生伴出血、疼痛等;(5)过敏反应、胰腺炎、白细胞减少、雷诺综合征、糖尿病、血尿等较少见。
2 他克莫司
FK506 为一种大环内酯类抗生素,是继CsA 后的又一CNI 类药物。1994 年被美国FDA 批准用于肝移植临床,1997 年被批准用于肾移植,1999 年在我国上市。2011 年FK506 缓释剂型在我国上市,为移植受者带来方便,提高了服用药物的依从性。
2.1 作用机制
FK506 和体内FK506 结合蛋白12(FK506 binding protein 12,FKBP12)相结合形成复合物,该复合物专一性地与钙调磷酸酶结合并抑制钙调磷酸酶的活性,从而抑制T 细胞中产生钙离子依赖型信号转导通路,阻止淋巴因子基因的转录,影响IL-2 和其他细胞因子如IL-3、IFN-γ、肿瘤坏死因子(tumornecrosis factor,TNF)-α 等的表达和CD25 的表达,抑制CTL 的生成。
2.2 用法用量
与CsA 相比,FK506 具有有效剂量小和对正在发生的排斥反应有效的优点,已成为器官移植的一线基础药物之一。
FK506 包括静脉和口服两种剂型。FK506 起始用量为0.05~0.15 mg/(kg·d);儿童的起始剂量应是成人推荐量的1.5~2.0 倍,以达预期的血药浓度;老年人使用FK506 可以适当减少剂量。
FK506 对胚胎和婴幼儿具有毒性,并且能够分泌进入乳汁,在育龄妇女中应用FK506 应充分权衡利弊,处于哺乳期的妇女服用FK506 则不应哺乳。
使用FK506 时应避免与布洛芬、氨基苷类抗生素及其他肾毒性药物联合使用。
2.3 药物相互作用
FK506 通过细胞色素酶系统进行代谢,因此诱导或抑制细胞色素酶CYP3A5 的药物,均可对其代谢产生影响。已知可以提高、降低FK506 血药浓度的药物与CsA 相类似。
2.4 药物不良反应
(1)神经毒性和消化道不良反应较明显,临床表现有头痛、失眠、无力、恶心、呕吐、腹泻等;(2)肝、肾功能损伤,高钾血症及低镁血症;(3)常见的不良反应还有高血压、白细胞增多等;(4)胰岛细胞毒性,导致胰岛素的合成和分泌减少继发高血糖。
FK506 的不良反应与其血药浓度密切相关,大部分不良反应在停药或减量后均能缓解,故使用时应加强FK506 血药浓度监测。
3 吗替麦考酚酯
MMF 为几种青霉菌的发酵作用产物,霉酚酸(mycophenlic acid, MPA) 是MMF 的活性成分。1995 年MMF 被美国FDA 批准用于肾移植排斥反应的预防治疗。在与CsA 和糖皮质激素联合使用时,MMF 比AZA 更为有效地预防排斥反应的发生。
3.1 作用机制
MPA 抑制T、B 淋巴细胞,平滑肌细胞和成纤维细胞的增殖。MPA是次黄嘌呤核苷酸脱氢酶(inosine monophosphate dehydrogenase,IMPDH)的非竞争性、可逆性抑制剂,而IMPDH 是鸟嘌呤核苷酸合成的限速酶,抑制IMPDH 便可导致鸟嘌呤核苷酸的耗竭,进而阻断DNA 的合成。
MPA 抑制T、B 淋巴细胞在有丝分裂原和同种异体抗原刺激下所引起的增殖,抑制B 淋巴细胞生成抗体。MPA 抑制与内皮细胞黏附有关的淋巴细胞和单核细胞表面黏附分子的糖基化,从而阻断淋巴细胞和单核细胞向排斥反应和炎症部位的迁移。
3.2 用法用量
临床肾移植推荐口服MMF初始剂量为0.75~1.00 g(剂型包括胶囊和片剂,分别为每粒250 mg 和每片500 mg),每日2 次,于移植术前12 h 或移植术后24 h 内开始口服。维持治疗根据临床表现或MPA 血药浓度曲线下面积(area under curve,AUC)调整剂量。静脉滴注MMF 的剂量为每瓶500 mg, 建议0.75~1.00 g,每12 h 1 次,采用5% 葡萄糖盐水两步稀释法配制,稀释浓度建议为6 mg/mL,静脉缓慢滴注应超过2 h,速度为84 mL/h 左右。静脉滴注MMF的疗程一般为7~14 d,主要适用于胃肠道功能异常,或不能进食的患者,如无禁忌应改为口服。大剂量MMF(2 g/d)可用于持续性或难治性急性排斥反应的挽救性治疗,其逆转疗效优于大剂量糖皮质激素,可减少移植肾丢失,改善肾功能,降低患者病死率或治疗失败率。随着MMF 剂量的增大,应警惕药物不良反应的发生率相应增加。
3.3 药物相互作用
(1)MMF 与干扰肠肝循环的药物同时联用,后者会降低MMF 的药效,而与FK506 合用,会使血药浓度升高。(2)MMF 与阿昔洛韦或更昔洛韦合用时,二者的血药浓度均高于单药服用;当肾功能不良时两药竞争性地通过肾小管排泄,使两种药血药浓度进一步升高,增加发生药物不良反应的危险。(3)MMF 与抑酸剂、氢氧化镁、氢化铝同时服用时会降低MMF 的吸收。(4)MMF 不会影响CsA 的药代动力学。
3.4 药物不良反应
MMF 无肝毒性、肾毒性和神经毒性,较适用于肾功能不全的患者。对有严重慢性肾功能损害的患者,除移植麻醉恢复后使用以外,应避免每日剂量超过2 g。常见的不良反应包括:(1)机会性感染,尿路感染、巨细胞病毒及疱疹病毒感染等,会增加巨细胞病毒性肺炎的发生率;(2)骨髓抑制,如外周血白细胞减少,服药期间中应当密切复查血常规,尤其是刚开始服药阶段;(3)消化道症状,恶心、呕吐、腹泻、便秘、胃肠道出血等,胃肠道不良反应多为剂量依赖性,降低剂量多能缓解;(4)与其他免疫抑制剂联合应用时,可能会增加淋巴瘤和其他恶性肿瘤(特别是皮肤癌)发生的风险。
4 麦考酚钠肠溶片
EC-MPS 是肠衣片型的MPA 钠盐,其活性成分同样是MPA,与MMF 在分子结构上的差异在于以钠盐替代了酯基团。MMF 需要在胃内酸性条件下分解为MPA 和羟乙基吗啉,后者对胃肠道具有刺激作用,而EC-MPS 在酸性环境下会保持相对稳定,其在胃内保持片剂状态,进入非酸性环境的小肠,片剂破裂释放出的MPA 被吸收,与MMF 体内代谢的结果是相同的。EC-MPS 肠溶剂型的主要作用是能够改善MPA的胃肠道不良反应,多项临床研究结果显示与MMF治疗组比较,EC-MPS 治疗组患者由于胃肠不良反应或感染所致的剂量调整和停药的发生率均低于MMF。
同时MMF 需要在胃内酸性条件下才能分解成MPA和羟乙基吗啉,而器官移植受者术后多需要服用质子泵抑制剂(proton pump inhibitor,PPI),PPI 影响胃内酸性环境,因此MMF 与PPI 联用,MPA 暴露量会下降,而EC-MPS 的药代动力学并不受此影响,故使用PPI 类药物时,EC-MPS 较MMF 更有优势。针对服用MMF 胃肠道不耐受的患者,换用EC-MPS 后胃肠道症状可得到改善,MPA 耐受剂量会增加。
由于MPA 衍生物与其他免疫抑制剂联用时效果良好,且无肾毒性,MMF 和EC-MPS 已基本替代AZA,是目前AZA 的首选替代药物。
4.1 作用机制
与MMF 相同。
4.2 用法用量
EC-MPS 为片剂,每片180 mg,免疫抑制效力相当于MMF 250 mg,推荐初始剂量360~720 mg,每日2 次。
4.3 药物不良反应
与MMF 相同。
5 硫唑嘌呤
5.1 作用机制
AZA 为嘌呤类抗代谢剂,干扰细胞分裂,抑制核酸生物合成,进而抑制活化的T、B 淋巴细胞的增殖,以及其他细胞类型如红细胞前体的增殖,并可引起DNA 损害。
5.2 临床应用
AZA 对初次免疫反应具有很强的抑制作用,但对再次反应几乎无任何作用,故其仅适用于器官移植术后排斥反应的预防性治疗;近20 年来临床上AZA已被MPA 类衍生物替代。较多见于早期(MPA 类药物在我国未上市时)的肾移植受者小剂量应用。对不耐受MPA 或多瘤病毒(BK 病毒)感染等的受者仍可考虑选择性应用。
5.3 药物不良反应
(1)骨髓抑制,白细胞、血小板减少和贫血;
(2)胆汁淤积和肝功能损伤;(3)可发生皮疹,偶见肌萎缩。
6 咪唑立宾
MZR 早期作为抗真菌药物开发,以后发现其具有免疫抑制效应,1984 年MZR 获日本厚生省批准用于肾移植术后排斥反应的预防治疗,1999 年在我国上市。可替代AZA 与其他免疫抑制剂构成不同的组合方案。
6.1 作用机制
MZR 是一种嘌呤类似物,在细胞内通过腺苷激酶磷酸化形成有活性的5- 磷酸MZR,后者是次黄嘌呤单核苷酸脱氢酶和鸟苷酸合成酶的竞争性抑制物,故MZR 能竞争性抑制嘌呤合成系统中的肌苷酸至鸟苷酸途径从而抑制核酸合成。阻止增殖的淋巴细胞由G0 期进展为S 期,抑制抗体的产生及记忆性B 淋巴细胞和记忆辅助性T 淋巴细胞的产生,延长移植物的存活。体外试验证明,MZR 具有以下免疫抑制作用:(1)抑制淋巴系统的细胞增殖;(2)抑制各种致有丝分裂因子引起的母细胞化反应;(3)抑制初次应答及二次应答的抗体产生。
6.2 临床应用
MZR 为片剂, 初始剂量为2~3 mg/(kg·d), 每日早晨顿服或分两次服用,以后逐渐减量至维持剂量1~3 mg/(kg·d)。MZR 的使用方案包括与其他免疫抑制剂联合使用,作为器官移植后初始免疫抑制剂,也可在发生AZA 或MPA 类药物引起的白细胞减少、肝功能异常或腹泻等严重消化道不良反应时,作为替代药物治疗。MZR 不要求进行血药物浓度监测,主要根据受者对其的耐受性来调整剂量。既往对本剂有严重过敏症史患者、白细胞计数<3×109/L 的患者、孕妇或可能妊娠的妇女禁用。
6.3 药物不良反应
(1)高尿酸血症为常见不良反应;(2)与AZA或MPA 类抗增殖类相比,骨髓抑制作用较轻,也可出现血小板减少、红细胞减少等,必要时可减量、停药,加服升白细胞药物等对症治疗;(3)偶可出现食欲不振、恶心、呕吐、腹痛、腹泻。
7 来氟米特
LEF 为人工合成的异唑衍生物类抗炎及免疫抑制剂。
7.1 作用机制
LEF 具有抗增殖活性,能高效、特异、非竞争性抑制线粒体内二氢乳酸脱氢酶的活性,通过抑制嘧啶的全程生物合成,影响活化的淋巴细胞嘧啶合成,使T 淋巴细胞和B 淋巴细胞的增殖停止在G1 期,从而抑制淋巴细胞介导的细胞性和体液性免疫应答。
7.2 临床应用
LEF 与目前使用的免疫抑制剂在化学结构上无任何相似性,近年来,有学者尝试将其用于肾移植临床,预防排斥反应的发生。在国内外研究中证实,LEF 确实可延长移植物生存,可替代MMF 或AZA,但是在实际临床应用中,LEF 通常不作为临床各移植中心的首选免疫抑制联合方案,主要是由于其不良反应较多,长期应用患者耐受性差。但是,LEF 对巨细胞病毒(cytomegalovirus,CMV)、BK 病毒复制亦具有一定的抑制作用。故临床上移植科医师可在确认BK病毒感染或BK 病毒性肾病时更换LEF 维持治疗,可获良好的效果。
用法用量:LEF 为片剂,每片10 mg。半衰期较长,24 h 给药1 次。使用方法为前3~5 d,每日50 mg 的负荷剂量,之后每日20 mg 维持。
禁忌证:孕妇和哺乳妇女禁用。
7.3 药物不良反应
较常见的有腹泻、瘙痒、可逆性丙氨酸转氨酶(alanine aminotransferase,ALT)和天冬氨酸转氨酶(aspartate aminotransferase,AST)升高、脱发、皮疹、白细胞下降等。
8 西罗莫司
SRL 又称雷帕霉素,为大环内酯类抗生素。1999 年由美国FDA 批准上市用于肾移植受者预防器官排斥反应,2000 年SRL 口服液在中国上市,2008 年SRL片剂在我国上市,与口服液相比,片剂的保存和服用更为方便。
8.1 作用机制
哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)是一种多功能激酶,在淋巴细胞的共刺激活化和细胞周期中均存在,主要作用机制: 与FKBP12 相结合形成复合物(SRL-FKBP12-mTOR)能抑制钙依赖性和非钙依赖性的IL-2R 后转导信号,以及由非淋巴性细胞因子如纤维母细胞生长因子(fibroblast growth factor,FGF)、干细胞因子(stemcell factor,SCF)、血小板源性生长因子(platelet-derived growth factor,PDGF)等因子所传递的增殖信号,从而阻断T 淋巴细胞及其它细胞周期中由G1 期至S 期的进程,在转录水平上抑制蛋白质的合成。
SRL 抑制丝裂原诱导的T 淋巴细胞增殖但不影响细胞因子和细胞因子受体的表达,SRL 也抑制外源性细胞因子(IL-2、IL-4 和IL-15)激发T 淋巴细胞的活化和增殖,以及抑制B 淋巴细胞产生抗体。SRL 与CNI 免疫抑制的重要区别在于,SRL 只影响IL-2R 的信号传递,并不像CNI 那样干扰IL-2的转录与合成。因此SRL 虽可抑制由IL-2 介导的T 淋巴细胞增殖,但并不抑制由IL-2 所介导的T 淋巴细胞凋亡过程,而后者对于免疫耐受或免疫低反应性的诱导和维持起着重要的作用。
8.2 临床应用
目前,国内外SRL 在器官移植术后的应用包括以下两种方式:在器官移植的受者中立即使用,即为初始治疗;在稳定期的受者中替换其他免疫抑制剂,包括在器官移植术后发生肿瘤的受者,又称为转换治疗。
器官移植术后初始治疗包括以下3 种方案:
(1)SRL+CNI+ 糖皮质激素,加用或者不加用诱导治疗;(2)CNI(慢撤离或低剂量长期合用)+SRL+糖皮质激素治疗;(3)不含CNI 的两联方案(SRL+糖皮质激素)或者三联方案(SRL+MPA+糖皮质激素),多数加用诱导治疗,本方案多用于老年受者或者边缘性供者的器官移植,以减少CNI 的肾毒性。不含CNI方案不推荐作为初始治疗方案。
器官移植术后转换治疗包括以下3 种方案:
(1)减量使用CNI,在原有CNI+MPA+ 糖皮质激素三联方案中减少CNI 的用量,加用SRL,构成低剂量的四联方案,此方案需要适当减少抗增殖药物的剂量,以免增加感染的风险;(2)替代MPA,将原有CNI+MPA+ 糖皮质激素三联方案中的MPA 撤除,换为SRL;(3)替代CNI,在原有CNI+SRL+ 糖皮质激素三联方案中撤除CNI 后,SRL 单独与糖皮质激素两联应用或者加用MPA 构成三联方案。
8.3 药物不良反应
(1)最常见的不良反应为高脂血症,机制尚不清,现已证明SRL 血药谷浓度与血清总胆固醇(total cholesterol,TC)和甘油三酯水平显著相关;(2)SRL 与蛋白尿的发生密切相关,合并糖尿病的受者较易在转换后出现蛋白尿;(3)可能会引发与SRL 相关性间质性肺炎;(4)可导致骨髓抑制及切口愈合不良。
9 糖皮质激素类药物
糖皮质激素是器官移植中最常用的免疫抑制剂,在器官移植的免疫抑制治疗中占有重要的地位。
9.1 作用机制
糖皮质激素免疫抑制作用的具体机制主要包括:(1)诱导IL-10 等抗炎因子的合成;(2)抑制树突状细胞成熟及抗原提呈功能;(3)抑制促炎因子的合成;(4)抑制单核细胞、中性粒细胞和巨噬细胞向炎症部位募集;(5)诱导炎症细胞凋亡。
9.2 临床应用
各大移植中心糖皮质激素使用经验不一样。常规诱导方案采用移植术中经静脉使用甲泼尼龙500~1000 mg (10~15mg/kg),术后前3 日每日静脉滴注250~500 mg,在使用多克隆抗体进行免疫诱导时,一般应减少甲泼尼龙的剂量。术后第4 日起改为泼尼松顿服,起始为10~30 mg/d,术后第30 日逐渐递减为10~15 mg/d,进入维持治疗阶段后多数移植中心采用小剂量维持,通常2~3 个月时为10 mg/d,6 个月时为5~10 mg/d,半年后为5.0~7.5 mg/d。
9.3 药物不良反应
(1)增加感染和恶性肿瘤的发生,增加病毒性肝炎和肝癌的复发率;(2)易引起移植后糖尿病及代谢性骨病;(3)可致伤口愈合延迟;(4)长期使用可致白内障、高血压、肥胖、骨质疏松、消化道溃疡、儿童生长抑制、肾上腺皮质功能减退等。
三、器官移植常用免疫抑制方案技术规范
器官移植受者免疫抑制方案应用的基本原则包括:(1)在有效预防排斥反应的前提下,尽量减少不良反应;(2)采用免疫抑制剂联合用药方案,利用免疫抑制剂协同作用,增加药物的免疫抑制效果,同时减少各种药物的剂量,降低其不良反应;(3)遵循个体化的用药原则,制定个体化的用药方案,即根据不同的个体,或同一个体不同时段以及个体对药物的顺应性和不良反应调整用药种类和剂量;(4)由于存在个体的药代动力学差异,某些药物如CNI 类需要通过监测血药浓度来调整用量;(5)关注药物间相互作用以平衡其免疫强度,从而降低受者因免疫功能降低所致的继发感染和肿瘤的发生率。
为移植受者制定合理的免疫抑制方案应结合供受者组织配型免疫学特点、供受者器官匹配程度、供受者年龄、供器官缺血- 再灌注损伤程度、受者依从性以及个体对药物的敏感性和不良反应等因素进行综合评估。
免疫抑制方案在各种器官移植及联合移植(胰肾、肝肾等联合移植)虽有不同,但基本原则却大同小异,包括免疫诱导方案、维持方案和排斥反应治疗时方案,现以肾移植为例介绍如下。
1 肾移植的免疫诱导方案
免疫诱导治疗是指移植围手术期短期使用的单克隆或多克隆抗体类免疫抑制治疗。诱导治疗有以下3 个目的:(1)降低移植物排斥反应的发生率及严重程度,以直接改善移植的效果;(2)免疫维持治疗方案中的CNI 类药物或糖皮质激素安全减量甚至停用,以降低其长期服用所带来的不良反应;(3)可能诱导受者产生针对移植物特异性的临床免疫耐受状态,以大幅减少维持治疗的总体免疫抑制剂所需剂量。
1.1 免疫诱导治疗方案的原则
对于诱导治疗方案的选择,需要根据供受者的诸多危险因素进行综合考虑。通常对于发生DGF 及排斥反应高风险者多选择T 淋巴细胞清除性抗体进行诱导治疗。主要包括:(1)免疫因素,预存供体特异性抗体(donor specific antibody,DSA)、群体反应性抗体(panel reactive antibody,PRA)水平显著升高,以及再次移植等情况;(2)供者因素,扩大标准或边缘性供肾、心脏死亡器官捐献(donation after cardiac death,DCD)、供肾脏冷保存时间过长超过12 h ;(3)受者因素,心血管疾病史、体质量指数(body mass index,BMI)>35 kg/m2、丙型肝炎病毒(hepatitisC virus,HCV)阳性、年龄>60 岁、不同种族。
1.2 兔抗人胸腺细胞免疫球蛋白
rATG 是家兔接受儿童胸腺组织免疫刺激而产生的多克隆抗体,其中包含针对T 淋巴细胞、B 淋巴细胞以及其他胸腺组织抗原的多种特异性抗体。在人体内使用后,rATG 能很快诱导CD2+、CD3+、CD4+、CD8+、CD16+、CD25+ 及CD45+ 淋巴细胞的显著清除,甚至能杀伤部分浆细胞,因而rATG 被认为是作用较强的免疫诱导药物。
目前对于rATG 诱导治疗的最佳使用剂量及方法尚缺乏全球共识,不同国家及移植中心对rATG的使用方法也存在较大的差异。我国使用较多的方案包括:(1)rATG 50 mg/d, 使用3 d( 第0~2日, 以移植当日为第0 日);(2)rATG 首剂50 mg(第0 日),之后25 mg×4 d(第1~4 日);(3)rATG 25 mg/d,使用3 d(第0~2 日)。前两种方案rATG 使用总量为150 mg,一般用于免疫高危受者的诱导治疗。第3 种方案仅用rATG 总量为75 mg,属于小剂量诱导治疗方案,可作为免疫低危初次移植的诱导治疗选择。
1.3 兔抗人T 淋巴细胞免疫球蛋白
ATG-F 是采用人T 淋巴母细胞样细胞系免疫刺激兔而产生的多克隆抗体,其所针对的特异性抗原谱较rATG 窄,主要针对T 淋巴细胞,具有良好的清除作用。
目前ATG-F 也广泛用于肾移植的诱导治疗,其使用方案与rATG 类似,每支100 mg 的ATG-F 用于替换每支25 mg 的rATG。
1.4 猪抗人T 细胞免疫球蛋白
猪抗人T 细胞免疫球蛋白是用人T 淋巴细胞免疫猪后,取其血浆经去除杂抗体、纯化、浓缩后得到,主要用于临床器官移植排斥反应预防和治疗,由我国武汉生物制品研究所生产,中国国家食品药品监督管理总局批准临床应用。与上述rATG 和ATG-F 的作用机制类似,对T 淋巴细胞具有短期清除作用。
药物不良反应:发热、寒战、荨麻疹、血清病、严重者出现过敏性休克。
禁忌证:异种蛋白过敏,严重的病毒、寄生虫、全身性霉菌感染,血小板严重缺乏者。
1.5 巴利昔单抗
见第215 页。
2 肾移植的免疫维持方案
随着免疫学的发展,新型免疫抑制剂的应用,可供选择的维持免疫治疗方案日益增多。虽然目前临床肾移植已有国际公认的首选免疫抑制维持方案,但由于不同免疫抑制剂在作用机制、免疫抑制强度以及不良反应等方面存在差异,维持治疗方案的选择还是应该遵循科学、个体、合理化的用药原则。目前临床上常用的口服免疫抑制剂主要分为3 大类:CNI、抗细胞增殖类抑制剂及糖皮质激素。一般情况下,分别选择上述3 大类中的一种药物进行组合,形成预防排斥反应的维持治疗“三联免疫抑制方案”。临床肾移植常用的维持方案为以下4 种。
2.1 足量CNI 三联免疫抑制方案
CNI 类药物是最重要的基础免疫抑制剂,其问世对器官移植具有划时代的重要意义,极大地提高了移植物的短期存活率。CsA 和FK506 两种药物相比,FK506 的免疫抑制作用更强且不良反应相对更低,因而成为现阶段肾移植术后首选的核心基础免疫抑制剂。美国FDA 及改善全球肾脏病预后组织(Kidney Disease: Improving Global Outcomes, KDIGO)指南均建议FK506+MPA+ 糖皮质激素为肾移植术后标准免疫抑制方案。
在以CNI 为基础的三联免疫维持方案应用过程中需要注意以下事项:(1)CNI 类免疫抑制剂早期血药浓度不达标是T 细胞介导排斥反应(T cellmediated rejection,TCMR)发生的危险因素。因此,初始用药应保证绝大多数受者第1 次血药谷浓度达到所需要的安全范围。对于FK506 而言,移植前检测受者的CYP3A5 基因型有助于更合理的初始用药剂量选择。(2)早期足量抗增殖药物MPA 的使用也有利于预防急性TCMR 的发生,其使用剂量也需要因人而异,具体用量要根据受者的性别、体质量、外周血白细胞计数及对药物的耐受性而定;因人种差异,中国人对抗增殖类药物的总体耐受性比欧美白种人低,需要适当降低初始剂量(如MMF 为1~2 g/d);在长期维持用药阶段,抗增殖类药物的剂量往往选择受者能长期耐受而不至于引起骨髓抑制不良反应的适宜剂量。(3)早期使用糖皮质激素对预防急性TCMR是必要的,各移植中心均有其糖皮质激素使用常规,通常遵循递减的原则,一般减至5.0~7.5 mg/d 维持。
2.2 无CNI 免疫抑制维持方案
虽然CNI 为基础的免疫维持方案在预防排斥反应方面效果良好,但长期使用(特别是血药浓度长期偏高)会带来明显的不良反应,尤其是慢性肾毒性,表现为慢性移植肾功能减退。因此无CNI 免疫抑制维持方案得以临床应用,其中最主要的是mTORi+MPA+ 糖皮质激素方案,特殊情况下也有单用mTORi 或MPA 与糖皮质激素组合。
CNI 转换为SRL 治疗所需的SRL 的目标浓度:(1) 早期转换为SRL+MPA+ 糖皮质激素(CNI慢撤除或直接撤除),SRL 血药谷浓度控制在4~10 ng/mL;(2)晚期转换为SRL+MPA+ 糖皮质激素(CNI 慢撤除或直接撤除)方案,将SRL 血药谷浓度控制在4~8 ng/mL。
CNI 转换为SRL 治疗的用法用量:(1)SRL 由于其半衰期长,通常采用每日顿服的给药方案,可固定饭前或饭后服药。(2)SRL 说明书中给药方法为负荷剂量6 mg,维持剂量2 mg,每日1 次,因给予负荷剂量有利于快速达到稳定血药浓度(3~4 d),否则需要7~14 d。临床应用时需注意给予负荷剂量可能造成血药浓度过高,引起与血药浓度相关不良反应,可根据受者的免疫情况、是否合并应用CNI 类药物等,考虑是否给予负荷剂量及具体应用剂量。
虽然无CNI 免疫维持治疗方案可以改善因CNI长期服用导致的移植肾功能损伤,但以下问题应引起关注:(1)安全性问题,免疫抑制不足可能导致急性排斥反应的发生率增加。(2)耐受性问题,mTORi 与MPA 类药物均有骨髓抑制不良反应,联合应用时易导致较多患者不能长期耐受;单用mTORi或MPA 对药物的剂量或血药浓度要求较高,也存在患者长期服用的耐受性问题。
因此,目前无CNI 免疫抑制方案使用并不普遍,尤其是不建议肾移植术后初始使用。在长期服用CNI为基础免疫抑制方案未发生过排斥反应的低危患者中,如出现血清肌酐慢性升高,且有明确证据证实其与CNI 肾毒性相关者,可以考虑转换为无CNI 免疫抑制维持治疗方案。
2.3 减量CNI 免疫抑制维持方案
由于CNI 类药物的肾毒性具有剂量依赖性,降低CNI 用量而不完全撤除可能成为一种较好的选择,既减轻了慢性肾毒性,又不至于让免疫抑制强度下降过多。目前减量CNI 免疫抑制方案包括两类:小剂量CNI+mTORi+ 糖皮质激素; 小剂量CNI+MPA+ 糖皮质激素。
2.3.1 小剂量CNI+mTORi+糖皮质激素 SRL 几乎没有肾毒性,且具有独特的诱导耐受的免疫学优势,其联合CNI 的理由包括:(1) 从药理机制上,CNI在T 细胞周期的较早阶段(G 期到G1 期)发挥阻断作用,而mTORi 在T 细胞增殖周期中G1 期向S 期发挥阻断作用。由于两者作用在T 细胞激活的不同阶段,因而可能具有良好的协同免疫抑制作用;(2)CNI 的毒性作用呈剂量相关性,减量CNI 能显著减少其慢性肾毒性;(3)与CNI 联用时,mTORi的谷值不必过高,控制在5~7 ng/mL 即可,有利于减轻mTORi 的不良反应。
2.3.2 小剂量CNI+MPA+ 糖皮质激素 小剂量CNI+MPA+ 糖皮质激素是另一类减剂量CNI 免疫抑制方案。由于MPA 的总体免疫抑制强度可能弱于mTORi,即使患者能够较好地耐受足量MPA,CNI的剂量也不宜减过多(一般减30% 以内)。由于考虑排斥反应的风险,建议这种方案仅用于长期稳定的免疫低危患者。
2.4 CNI 类药物相互间转换方案
CNI 类药物主要包括CsA 和FK506,肾移植受者对两种药物的耐受情况往往不同。目前国内外均提倡优先选择FK506,但BMI 高、糖尿病或胰岛功能异常、乙型肝炎病毒(hepatitis B virus,HBV)和HCV 携带的受者可选择CsA。
CNI 类药物之间的转换一般出现在对已用药物不耐受或者出现明显不良反应时。原因包括:(1)CsA转换为FK506,可能因免疫不足而导致血清肌酐升高、高胆红素血症、CsA 所致多毛、齿龈增生等不良反应;(2)FK506 转换为CsA,可能因使用FK506 后出现药物性肾损伤、FK506 血药浓度过低或服药量过大、药物性糖尿病等不良反应时。
转换的方法:CsA 转换为FK506 时,转换的剂量按30~50 mg∶1 mg,建议采用50 mg∶1 mg。反之,FK506 转换为CsA 也相同。
转换注意事项:两种药物转换时需要停服1 顿(12 h)CNI 类药物;然后服用转换后的CNI 并于转换后3~7 d 复查转换药物的血药浓度,以其尽快达到CNI 目标浓度。
3 肾移植急性排斥反应冲击治疗方案
肾移植术后早期发生急性排斥反应,糖皮质激素冲击疗法作为一线治疗方案。大部分细胞介导的急性排斥反应对激素冲击疗法有效。静脉滴注3~5 d 后,改为口服糖皮质激素维持。
重度细胞介导的急性排斥反应(Banff 分级≥Ⅱ A 级)常需要ATG 治疗,ATG 治疗同时给予抗生素,以预防感染。
急性抗体介导的排斥反应对单纯激素冲击疗法或单纯ATG 治疗疗效不佳。此时应尽早采用以下方案:(1)清除受者体内已有的抗体,包括血浆置换和免疫吸附等;(2)阻断或延迟抗体介导的初级和次级组织损伤作用,包括大剂量静脉注射用免疫球蛋白(intravenous immunoglobulin,IVIG)等;(3)抑制或清除体内抗体的继续产生,如应用抗B细胞药物利妥昔单抗(rituximab)和抗浆细胞活性的蛋白酶体抑制剂硼替佐米(bortezomib)等。
四、器官移植免疫抑制剂血药浓度监测技术规范
免疫抑制剂血药浓度监测意义重大,其检测的数据受多种因素影响:(1)受者因素,术后时间、状态、术后用药尤其是增加或降低其他免疫抑制剂;(2)检测设备的性能和检测方法;(3)各移植中心检验质控体系。故在分析受者的免疫抑制剂血药浓度时应综合考虑。
1 环孢素血药浓度监测
1.1 临床意义
CsA 在治疗剂量下,其生物利用度和药代动力学的个体差异及机体对CsA 的敏感性和差异性很大,治疗过程中进行血药浓度监测可以降低排斥反应和药物不良反应的发生率,提高移植器官的存活率。相关研究表明,移植受者CsA 的浓度- 时间AUC 是移植物存活和急性排斥反应发生的敏感预测因素,而个体内CsA 的AUC 变异性则是慢性排斥反应的危险因素之一。
1.2 检测方法
准确的AUC 测定方法,操作复杂、费用昂贵、不便临床应用。研究发现,CsA 服药后2 h 的血药峰浓度(C2)与AUC 相关性最大,此时CsA 达到最高浓度,因此,临床上主要依靠患者CsA 服药后12 h的血药谷浓度(C0)和C2 来指导临床用药。
CsA 血药浓度检测法有酶放大免疫测定技术(enzyme-multiplied immunoassay technique, EMIT)、酶联免疫吸附试验(enzyme-linked immune absorbentassay,ELISA)、放射免疫法(radioimmunoassay,RIA)、荧光偏振免疫测定(fluorescence polarization immunoassay,FPIA)、高效毛细管电泳(high performance capillary electrophoresis,HPCE)、高效液相色谱技术(high performance liquid chromatography,HPLC)、液相色谱- 串联质谱(liquid chromatography tandem mass spectrometry,LC-MS/MS)等。EMIT 法和FPIA 法是目前临床上采用的主要方法,具有灵敏、快速、自动化程度高的优点,检测过程在1 h 以内,当测试完毕后,检测仪器可自动根据标准曲线计算待测样本的CsA 血药浓度。HPLC法和LC-MS/MS 法检测结果准确,可区分CsA 母药和代谢产物,但耗时较长,操作过程复杂,技术要求高,不能进行批量样品操作,在临床应用上受到限制。
RIA 采用放射性核素3H 或125I 标记CsA 作为示踪剂,也具有灵敏度高、精确度高的特点,在具有放射性核素检测资质的中心,也是可选用的检测方法。
1.3 监测频率
移植术后短期内隔日检测,直至达到目标浓度;在更改药物或受者状况出现变化可能影响血药浓度时,随时测定;出现肾功能下降提示有肾毒性或排斥反应时,随时测定。
1.4 目标血药浓度
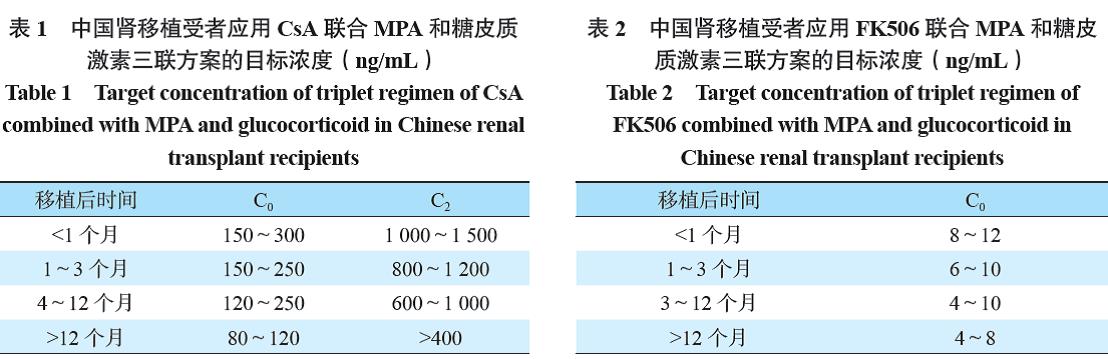
移植术后要监测CsA C0、C2或浓度-时间AUC。CsA 血药浓度治疗窗详见表1。
2 他克莫司血药浓度监测
2.1 临床意义
FK506 是属于狭窄治疗指数药物,即药物的疗效、毒性与血药浓度密切相关。
2.2 检测方法
FK506 在血液中绝大部分分布于红细胞,血浆药物浓度与全血药物浓度不一致,目前使用全血样本检测受者体内的血药浓度。血药浓度检测血样采集时间为移植受者次日晨服药前(谷值),抽取全血1 ml置于乙二胺四乙酸(ethylene diamine tetra acetic acid,EDTA)抗凝试管中,采用校准品制作标准曲线,以此为基础计算结果。
目前临床常用的血药浓度监测方法为免疫分析法,因试剂商品化、自动化程度高、准确性和重复性较好、检测速度快、操作方便等特性,在临床常规检测中得以广泛应用。比较常用的几种免疫分析方法:化学发光微粒子免疫法(chemiluminescence microparticle immunoassay, CMIA)和EMIT 法有自动化程度高、操作简单、测试速度快(1 h)、所需样品量较少的特点,临床应用较成熟,均是国内广泛使用的检测方法。
受者的个别情况会干扰FK506 浓度测定结果,应注意分析:以CMIA 法为例,当总胆红素(total bilirubin,TB)>684 μmol/L、甘油三酯>20.8 mmol/L或尿酸>2 380 μmol/L 时,实际结果< 测定值12%;如有胆汁淤积时,实际结果< 测定值;经小鼠单抗治疗的受者,血中可能产生了抗鼠抗体,会影响测定结果。
2.3 目标血药浓度
详见表2。对于有新生抗供体特异性抗体(de novodonor specific antibody,dnDSA)阳性且肾功能稳定的肾移植受者,建议维持FK506 血药浓度>6 ng/mL。
3 霉酚酸类衍生物血药浓度监测
3.1 临床意义
MPA 类药物包括MMF 和EC-MPS。两者进入体内后,虽吸收时间及效率不同,在体内的有效成分均是MPA。MPA 在人体内药代动力学个体差异大,对服用MPA 的移植受者进行血药浓度监测,可防止或减少药物的毒性及不良反应,延长移植物存活期。98% 的MPA 与血浆蛋白结合,送检样本最好是EDTA 抗凝管全血。MMF 的监测时间为次日清晨服药前30 min(C0 谷值)、服药后0.5 h(C0.5)及服药后2 h(C2);EC-MPS 的监测时间根据联合服用CNI 的不同而异。
3.2 检测方法
主要包括EMIT 法和LC-MS/MS 法。后者操作复杂、耗时较长,因此临床应用较少;EMIT 法是最常用的方法,可采用商业化仪器及试剂检测,批量操作,快速准确。
3.3 影响MPA 清除的因素
影响因素包括肝、胃肠道和肾组织中葡萄糖醛酸转移酶,MPA 的肠肝循环,MPA 的游离部分比例,急、慢性肾功能损伤,其他免疫抑制剂的影响,移植后的时间及种族因素等。
4 西罗莫司血药浓度监测
4.1 临床意义
SRL 有效血药浓度范围窄,血药浓度易受药物影响,因此,临床要求对其血药浓度进行监测,制订个体化治疗方案。
4.2 检测方法
SRL 的血浆蛋白结合率>92%,最好采集全血置于抗凝管内进行检测,采样时间为次日清晨服药前(谷值)。
检测SRL 血药浓度的方法有CMIA 法、微粒子免疫测定(microparticle enzyme immunoassay,MEIA) 法、HPLC 法和LC-MS/MS 法等。CMIA 法和MEIA 法是临床广泛采取的免疫学检测方法,检测速度快、方便快捷。HPLC 法和LC-MS/MS 法检测结果准确,但需要时间长,操作程序复杂,不利于临床开展。
4.3 目标血药浓度
SRL 联合CNI 类及糖皮质激素作为初始治疗的血药谷浓度8~12 ng/mL;早期转化SRL+MPA+ 糖皮质激素方案是可行的,建议SRL 血药谷浓度4~10 ng/mL;晚期转换SRL+MPA+ 糖皮质激素方案,SRL 血药谷浓度控制在4~8 ng/mL。
五、器官移植药物性肝肾损伤治疗技术规范
器官移植受者(尤其是肾移植受者)常联合应用多种药物,加之受者自身的遗传因素、非遗传因素以及环境因素等作用,可导致药物性肝损伤(druginduced liver injury,DILI)和药物性肾损伤(druginduced kidney injury,DKI)。其中,CNI 类药物是最主要和最常见的具有肾毒性和肝毒性的免疫抑制剂,除了可直接造成毒性损伤效应之外,还可在一定程度上加重移植器官的其他损伤,如缺血- 再灌注损伤等。
此外,抗生素类药物、降糖调脂药物、部分中草药、抗肿瘤的化疗药物、抗结核药物、解热镇痛药物等均可导致DILI;抗生素类药物、非甾体抗炎药、造影剂、铂类抗肿瘤药物、渗透剂、利尿药、部分中草药等均可导致DKI。
1 药物性肝损伤
DILI 是指由各类处方或非处方的化学药物、生物制剂、传统中药、天然药、保健品、膳食补充剂及其代谢产物乃至辅料等诱发的肝损伤。DILI 是最常见的和最严重的药物不良反应之一,重者可致急性肝衰竭(acute liver failure,ALF)甚至死亡。
1.1 发生机制
药物及其中间代谢产物对肝脏的直接毒性作用。机体对药物的特异质反应,包括过敏性(免疫特异质)和代谢性(代谢特异质)。
1.2 诊断标准
当ALT、碱性磷酸酶(alkaline phosphatase,ALP)及TB 等指标升高合并或不合并腹腔积液、静脉曲张等门静脉高压表现时,可考虑DILI。鉴于部分患者表现为药物性自限性轻度肝损伤,此后可自行完全恢复,为避免不必要的停药,国际严重不良反应协会(International Serious Adverse Event Consodium,SAEC)于2011 年将DILI 的血清生化学诊断指标建议调整为出现以下任一情况:(1)ALT 升高达正常上限5 倍以上(≥5 ULN);(2)ALP≥2 ULN,特别伴有5’ - 核酸酶或γ- 谷氨酰转移酶(γ-glutamyl transferase,γ-GT)升高且排除骨病引起的ALP 升高;(3)ALT≥3 ULN 且TB≥2 ULN。
1.3 临床分类
按照病程特征分类:急性药物性肝病(肝脏炎症在6 个月内消退);慢性药物性肝病(>6 个月或再次肝损伤)。
按照临床表现特征分类:肝细胞损伤型(ALT≥3 ULN,且R≥5);胆汁淤积型(ALP≥2 ULN,且R≤2);混合型(ALT≥3 ULN,ALP≥2 ULN,且2<R<5)。若ALT 和ALP 达不到上述标准, 则称为“肝脏生化学检查异常”。R=(ALT 实测值/ALTULN)/(ALP 实测值/ALP ULN)。在病程中的不同时机计算R 值,有助于更准确地判断DILI 的临床类型及其演变。
1.4 治疗原则
(1)及时停用可疑损伤药物,尽量避免再次使用可疑或同类药物;(2)应充分权衡停药引起原发病进展和继续用药导致肝损伤加重的风险;(3)根据DILI 的临床表型选用适当的药物治疗;(4)ALF 和亚急性肝衰竭(subacute liver failure,SALF)等重症患者必要时可考虑紧急肝移植。
1.5 药物治疗
(1)较轻者以选抗炎类(如复方甘草酸单铵)和利胆药物为主,可加用解毒类药物如还原型谷胱甘肽减轻药物毒性,促进药物排出;单一药物无法控制时,应选用不同机制的护肝药物进行联合治疗。(2)重症者须应用N- 乙酰半胱氨酸(N-acetylcysteine,NAC),NAC 可清除多种自由基,临床应用越早越好。(3)糖皮质激素对DILI 的疗效尚缺乏随机对照研究,应严格掌握治疗适应证,宜用于超敏或自身免疫征象明显、且停用肝损伤药物后生化指标改善不明显甚或继续恶化的患者,并应充分权衡治疗受益和可能的不良反应。(4)如肝损伤仍无法缓解,可以调整免疫抑制方案。(5)存在胆汁淤积的DILI,可选用熊脱氧胆酸,抗炎类护肝药物因具有类似糖皮质激素的非特异性抗炎作用,也可用于药物引起的胆汁淤积,尤其是对于伴有明显炎症的患者有较好的疗效。对于急性淤积性肝病,糖皮质激素对部分患者有较好疗效。开始可用泼尼松每日30~40 mg,黄疸明显消退后可逐渐减量。使用1 周后如胆汁淤积无下降趋势或上升时应立即停药。
2 药物性肾损伤
DKI 是指由于药物治疗导致新出现的肾损伤或现有肾损伤加重。
2.1 发生机制
(1)剂量依赖直接肾药物毒性;(2)免疫反应相关非剂量依赖肾药物毒性;(3)药物引起肾血流量减少和电解质紊乱等导致间接肾毒性;(4)低溶解度药物结晶小管内沉淀导致尿路梗阻;(5)肾功能减退、低蛋白血症等诱发因素加重药物性肾损伤。
2.2 诊断标准
(1)可疑药物给药后新出现的肾损伤;(2)排除所有其他原因,停用可疑药物后肾损伤改善或终止进展。
2.3 治疗原则
根据DKI 发病机制及时治疗对肾功能恢复非常重要。基础治疗是停用可疑药物。如果停用可疑药物后仍存在肾功能障碍,可以考虑使用类固醇类药物。
2.4 免疫抑制剂相关性肾损伤的防治措施
2.4.1 定期血药浓度监测 2016 年日本药物相关性肾损伤临床实践指南提出,应定期对CNI 类药物进行血药浓度监测,预防药物急性毒性所致近端肾小管损伤,同时预防慢性毒性所致微血管病变和间质病变。必要时经肾活检组织学评估长期使用CNI 所致的潜在肾毒性。
2.4.2 保护肾功能原则 改善微循环、扩张肾血管、保证肾脏灌注、适当利尿。
2.4.3 调整免疫抑制方案 (1)将CsA 改为FK506 治疗:两药虽同属CNI,但有研究认为,CsA 可诱导转化生长因子(transforming growth factor,TGF)-β1过度表达,从而引起慢性移植肾肾病,而FK506 则没有这种作用。因此,将CsA 替换为FK506 进行免疫抑制治疗,可减轻或延缓肾功能损伤。(2)加用mTORi 进行治疗:mTORi 是丝氨酸- 苏氨酸蛋白激酶,是参与细胞内多个信号通路的重要物质,影响细胞生长、增殖、代谢、自噬和血管生成等诸多重要过程。多项研究均证明由CNI 转换为mTORi 可以改善移植肾功能。
致谢:全国31家肾移植中心在“肾移植免疫抑制剂方案与剂量调查问卷”中给予大力支持与帮助,特此感谢!
执笔作者:田普训 敖建华 李 宁 石炳毅
主审专家:石炳毅
审稿专家:
敖建华 中国人民解放军总医院第一医学中心
蔡 明 中国人民解放军总医院第八医学中心
陈 刚 华中科技大学附属同济医院
陈 正 广州医科大学附属第二医院
陈静瑜 无锡市人民医院
陈忠华 华中科技大学附属同济医院
丰贵文 郑州大学第一附属医院
付绍杰 南方医科大学南方医院
傅耀文 吉林大学第一医院
宫念樵 华中科技大学附属同济医院
郭 晖 华中科技大学附属同济医院
黄 洁 中国医学科学院阜外医院
黄赤兵 陆军军医大学新桥医院
霍 枫 中国人民解放军南部战区总医院
鞠卫强 中山大学附属第一医院
巨春蓉 广州医科大学附属第一医院
李 宁 山西省第二人民医院
李新长 江西省人民医院
林 涛 四川大学华西医院
刘 龙 中国人民解放军北部战区总医院
马麟麟 首都医科大学附属北京友谊医院
门同义 山东大学附属千佛山医院
明长生 华中科技大学附属同济医院
彭龙开 中南大学湘雅二医院
齐海智 中南大学湘雅二医院
曲青山 郑州人民医院
石炳毅 中国人民解放军总医院第八医学中心
眭维国 中国人民解放军联勤保障部队第九二四医院
孙启全 中山大学附属第三医院
孙煦勇 中国人民解放军联勤保障部队第九二三医院
田普训 西安交通大学第一附属医院
王 钢 吉林大学第一医院
王 莉 四川大学华西医院
王 毅 南华大学附属第二医院
王洪伟 山东大学第二医院
王彦峰 武汉大学中南医院
王长希 中山大学附属第一医院
吴建永 浙江大学医学院附属第一医院
武小桐 山西省第二人民医院
薛武军 西安交通大学第一附属医院
张伟杰 华中科技大学附属同济医院
张小东 首都医科大学附属北京朝阳医院
赵 明 南方医科大学珠江医院
郑 瑾 西安交通大学第一附属医院
周江桥 武汉大学人民医院
参考文献:略
文章来源:《器官移植》第10 卷 第3 期2019 年5 月
www.ahyllaw.com、安徽医疗纠纷律师、合肥医疗纠纷律师、安徽医疗事故律师、合肥医疗事故律师、安徽医疗律师、合肥医疗律师、医疗事故律师、医疗纠纷律师


