中华心血管病杂志(网络版)编辑委员会
● 引言
急性冠状动脉综合征(acute coronary syndrome,ACS)是指冠状动脉粥样硬化斑块破裂或侵蚀,继发完全或不完全闭塞性血栓形成所致的急性心肌缺血综合征。抗栓治疗是ACS 患者实现再灌注治疗的基石。近年来,随着我国农村地区居民急性心肌梗死发病率逐年升高,基层医疗卫生机构承担起一部分ACS 初始救治的重任。实施早期抗栓治疗,进一步制定转运策略、启动再灌注治疗是其中的核心环节。然而,首诊ACS患者的基层医务人员很多并非心血管专业,对规范化抗栓治疗和转运策略认识不足,亟需指导。鉴于这一情况,《中华心血管病杂志(网络版)》编辑委员会组织有关专家制订本共识,旨在帮助基层卫生医疗机构医务人员规范ACS 抗栓治疗及转运策略的实施,为后续再灌注治疗奠定基础,实现与上级医院的有效联动和转诊。
● ACS 的诊断
ACS,包括ST 段抬高型心肌梗死(ST-segment elevation myocardial infarction ,STEMI)、非ST 段抬高型心肌梗死(non-ST-segment elevation myocardial infarction,NSTEMI)和不稳定性心绞痛(unstable angina,UA)。其中,NSTEMI 和UA 又统称为非ST 段抬高型ACS(non-ST-segment elevation acute coronary syndrome,NSTE-ACS)(表1)。急性缺血性胸痛是ACS 患者最常见的临床表现。胸痛患者首次医疗接触(first medical contact,FMC)10 min[1-2] 内应尽快完成标准12 导联或18导联心电图(electrocardiogram,ECG)。结合症状及ECG 进行疾病类型鉴别(STEMI 或NSTE-ACS),并启动相应的治疗流程(图1)。
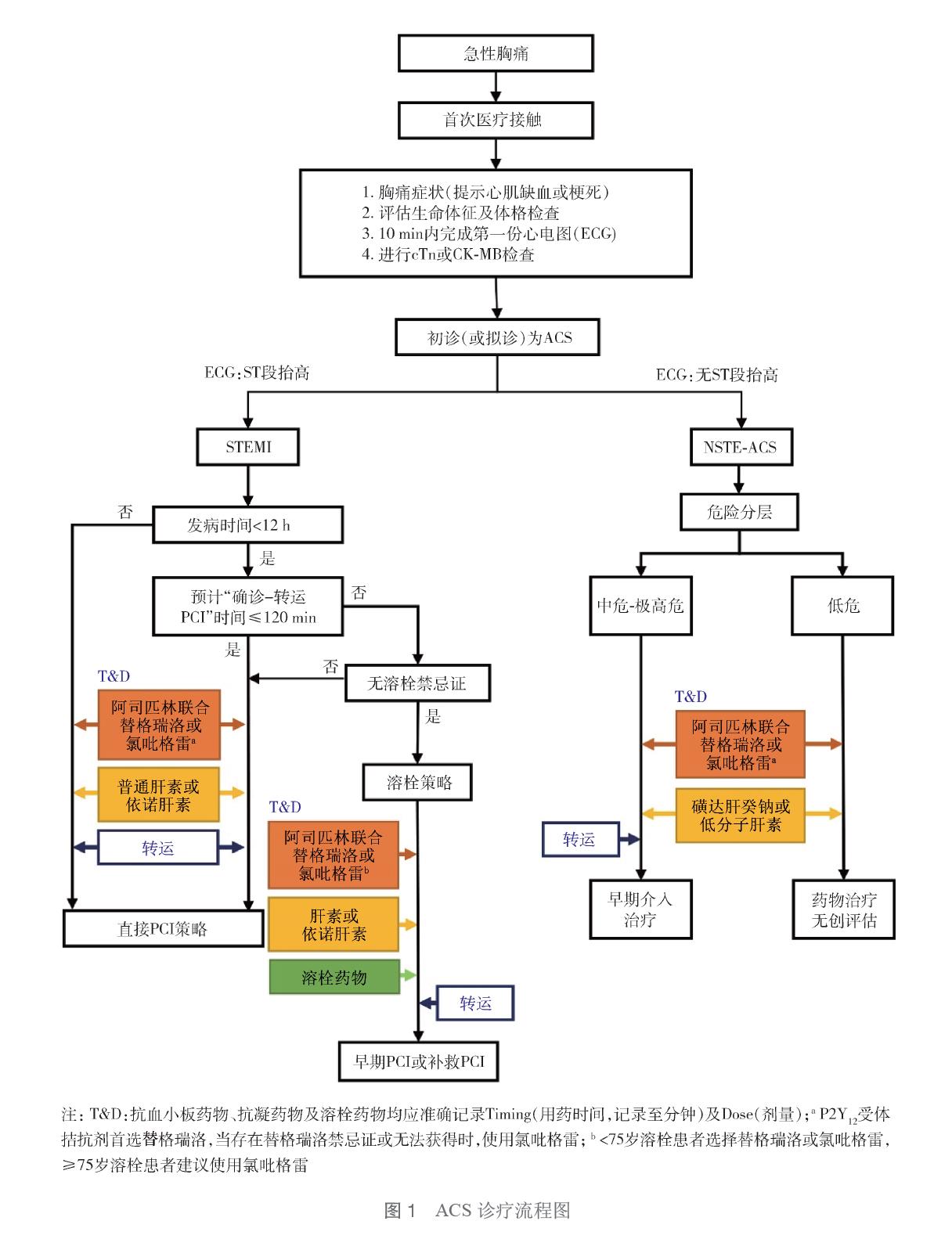
有条件的单位应对ACS 患者进行心肌损伤标志物检测,如肌钙蛋白(cardiac troponin,cTn)或肌酸激酶同工酶-MB(creatine kinase-MB,CK-MB),并动态观察其演变。但结合症状和心电图已能够确诊ACS,尤其是STEMI,不需等待心肌损伤标志物检查结果,应尽快启动抗栓治疗及选择再灌注治疗策略。
ACS 的诊断过程中需同时对其他可导致胸痛的致命性疾病,包括主动脉夹层、肺栓塞及张力性气胸等进行鉴别。尤其是主动脉夹层,不恰当抗栓治疗可能加重病情。
● ACS 患者的抗栓治疗
急性血栓形成是ACS 重要的发病机制,抗栓治疗是ACS 患者基础药物治疗手段。除非有禁忌证,所有ACS 患者一经确诊应尽快启动抗栓治疗并贯穿治疗的全过程。ACS 患者抗栓治疗包括抗血小板药物和抗凝药物两大类。前者主要包括环氧化酶抑制剂(阿司匹林)、P2Y12 受体拮抗剂(替格瑞洛、氯吡格雷)。后者主要包括普通肝素、低分子量肝素,Ⅹa 因子抑制剂(磺达肝癸钠)。活动性出血和出血性疾病是抗栓治疗的主要禁忌证,同时应注意不同抗栓药物的相应禁忌证及注意事项(详见附件1)。合并出血高危因素,如既往出血病史、高龄、肝肾功能不全、需联合使用口服抗凝药等,并不等同于抗栓禁忌证,不应因此延误抗栓治疗。对合并出血高危因素的患者,应制定个体化抗栓治疗方案,采取预防或减少出血风险的措施,并密切监测抗栓治疗相关的出血并发症。
ACS 患者转运至上级医院接受再灌注治疗前,应准确记录使用抗栓药物种类、剂量、确切使用时间,建议使用“ACS 患者基层转运抗栓治疗用药记录卡”(详见附件2),为上级医院后续抗栓治疗方案的制订提供参考。

一、抗血小板治疗
如无禁忌证,ACS 患者一经确诊,无论后续拟采用何种治疗策略(介入或药物治疗),均应立即启动双联抗血小板治疗,即阿司匹林联合一种P2Y12 受体拮抗剂,并维持治疗至少12 个月。
1. 阿司匹林:首次负荷剂量300 mg 嚼服,继以75~100 mg/d,口服维持。
2. P2Y12 受体拮抗剂:首选替格瑞洛,首次负荷剂量180 mg 口服,继以90 mg 2 次/d,口服维持。当存在替格瑞洛禁忌证或不能获得时,使用氯吡格雷,首次负荷剂量300~600 mg 口服,继以75 mg/d,口服维持。
拟行溶栓治疗的STEMI 患者,年龄<75 岁者,P2Y12 受体拮抗剂可选择替格瑞洛或氯吡格雷,替格瑞洛剂量用法同上,氯吡格雷首次负荷剂量为300 mg,维持剂量同上;年龄≥ 75 岁者,P2Y12 受体拮抗剂建议选择氯吡格雷,不使用负荷剂量,首剂75 mg 口服,继予75 mg/d,维持。
冠状动脉造影前不应常规应用血小板膜糖蛋白(glycoprotein,GP)Ⅱb/ Ⅲa 受体拮抗剂,如替罗非班或依替巴肽等。
二、抗凝治疗
肠道外抗凝是ACS 患者抗栓治疗的重要组成部分,应根据ACS 类型及拟接受再灌注治疗策略选择相应的抗凝方案。
1. STEMI 患者抗凝方案:(1)拟转运行直接经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)患者:首选普通肝素,负荷剂量70~100 U/kg 静脉推注。需监测患者凝血功能,目标活化部分凝血活酶时间(activated partial thromboplastin time,aPTT)为50~70 s 或正常对照值的1.5~2.0 倍, 活化凝血时间(activated coagulation time,ACT)为250~300 s。也可以考虑使用依诺肝素, 用法为0.5 mg/kg 静脉推注。高出血风险者可选用比伐卢定,静脉推注0.75 mg/kg,继而每小时1.75 mg/kg 静脉滴注,维持至PCI 后3~4 h,以减低急性支架血栓形成的风险。建议拟行直接PCI术的STEMI 患者,抗凝治疗推迟至PCI 术前使用。
(2)拟接受溶栓治疗的患者:抗凝是溶栓治疗的基础,溶栓需在肝素化抗凝的基础上进行。使用特异性溶栓剂患者,首选普通肝素。溶栓前使用负荷剂量50~70 U/kg(最大剂量4 000 U)静脉注射。溶栓结束后继以12 U·(kg·h)-1(最大剂量1 000 U/h)静脉滴注,维持至血运重建前或48 h 至8 d。需动态监测患者凝血功能, aPTT 为50~70 s 或正常对照值的1.5~2.0 倍。或使用依诺肝素, 年龄<75 岁者,负荷剂量30 mg 静脉推注,15 min 后予每12 h 皮下注射1 mg/kg,前两次皮下注射单次剂量不应超过100 mg;年龄≥ 75 岁者,不进行静脉推注,每12 h皮下注射0.75 mg/kg,前两次皮下注射单次剂量不应超过75 mg。使用非特异性溶栓剂( 如尿激酶) 患者,静脉肝素化后予溶栓治疗。溶栓结束后6~12 h 予皮下注射普通肝素7500 U 或低分子量肝素,每12 h 1 次,共3~5 d。
2.NSTE-ACS 患者抗凝治疗:NSTE-ACS 患者无论拟采用何种治疗策略(抗凝或PCI),磺达肝癸钠的药效和安全性最好,2.5 mg 皮下注射,每日1 次,最多8 d 或至血运重建前。使用磺达肝癸钠的NSTEACS患者,建议PCI 术中常规使用普通肝素进行抗凝,可以静脉推注普通肝素85 U/kg。磺达肝癸钠无法获得时,可选择低分子量肝素(主要是依诺肝素)。
依诺肝素每12 h 皮下注射1 mg/kg,最多8 d 或至血运重建前。使用依诺肝素的NSTE-ACS 患者,PCI 术中建议继续使用依诺肝素进行抗凝,不建议换用其他类型抗凝药物,依诺肝素的剂量根据术前最后一次使用的时间进行调整。
三、特殊ACS 患者抗栓治疗
1. 长期使用口服抗凝药(oral anticoagulants,OAC)的患者:长期使用OAC 为溶栓治疗的相对禁忌证,对于此类患者,应选择PCI 策略。急诊PCI 术前无需停用OAC,同时加用双联抗血小板治疗。术中推荐患者继续接受肝素抗凝治疗,无需考虑患者末次口服抗凝药的时间。应避免使用GP Ⅱb/ Ⅲa 受体拮抗剂。术后推荐三联抗栓治疗4~6 周后改为双联抗栓(P2Y12 拮抗剂+OAC),建议使用新型口服抗凝药。若患者存在无法纠正的高出血风险,且低血栓风险,则可在出院后就改为双联抗栓治疗。
2. 合并慢性肾功能不全(chronic renal insufficiency,CKD)的患者:ACS 合并CKD 需根据肾功能水平调整抗栓药物的选择和剂量(见表2)。

四、溶栓药物
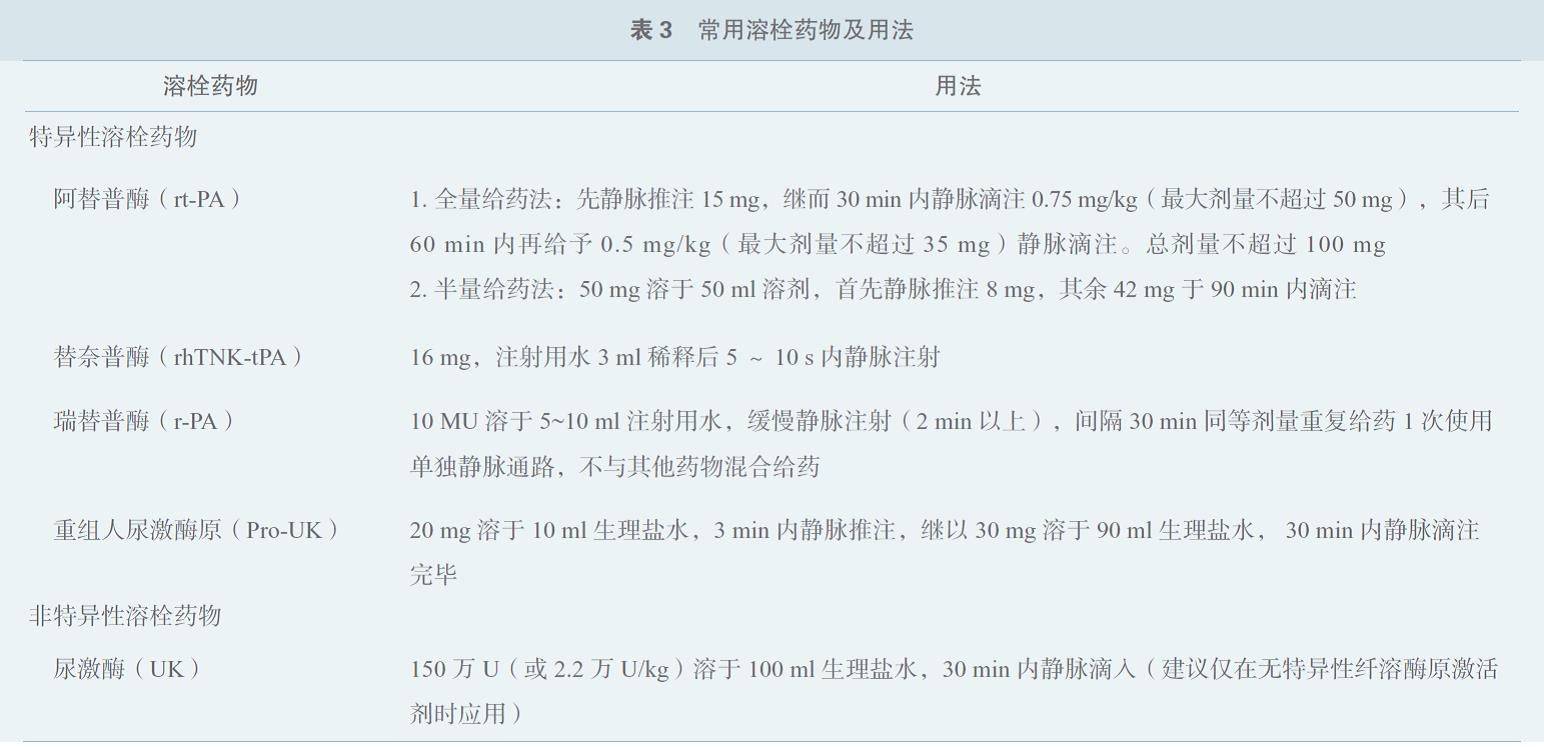
溶栓是STEMI 患者重要的再灌注治疗手段之一,NSTE-ACS 患者不建议溶栓治疗。溶栓适应证及禁忌证本共识不做具体介绍,相关内容可参考《ST 段抬高型急性心肌梗死院前溶栓治疗中国专家共识》及《急性ST 段抬高型心肌梗死溶栓治疗的合理用药指南》等相关指南或共识。常用溶栓药物及用法见表3。
● ACS 患者院间转运策略
随着“转运PCI”、“溶栓后早期PCI”等血运重建策略的运用及推广,ACS 患者区域协调救治重要性日益凸显。ACS 患者首诊于不具备PCI 条件的基层卫生医疗机构时,应在及时诊断及早期抗栓的基础上,根据患者疾病类型、危险分层及转运条件,快速制定后续再灌注治疗策略及相应的转运方案。
1. STEMI 患者:对于确诊STEMI 的患者,应根据“发病- 就诊”时间、预计“确诊- 转运PCI”时间、是否合并溶栓禁忌证等,选择再灌注治疗方式并制定转运策略(图1)。
对于“发病- 就诊”时间< 12 h 的STEMI 患者,若预计转运PCI 时间≤ 120 min,则应选择“直接PCI 策略”。对接胸痛中心网络,优先选择距离最近、具有急诊PCI 资质的医院,即刻转运;若预计转运PCI 时间> 120 min,则评估溶栓禁忌证:若患者存在溶栓禁忌证,也应选择“直接PCI 策略”,即刻转运;如患者不存在溶栓禁忌证,则应选择“溶栓策略”。争取在10~30 min内实施溶栓治疗。
接受溶栓的患者,如判断溶栓治疗失败,应尽快进行补救PCI;如判断溶栓成功,建议在溶栓后2~24 h 行早期PCI 治疗。因此,STEMI 患者接受溶栓后也应尽快转运至有PCI 资质的医院。对于发病时间≥ 12 h的STEMI 患者,溶栓治疗获益下降。如患者有持续性胸痛(心肌缺血)症状,或伴血流动力学不稳定,选择“直接PCI 策略”,即刻转运。
2.NSTE-ACS 患者:对于确诊或拟诊为NSTEACS的患者,应首先进行危险评估(表4)。并根据危险分层结果,选择治疗策略。极高危患者,建议于2 h 内行侵入性治疗;高危患者,建议于24 h 内行侵入治疗;中危患者,建议于72 h 行侵入治疗。

低危患者先行无创检查寻找缺血依据。因此,对于中危至极高危的NSTE-ACS 患者应在早期抗栓基础上,应尽早转运至PCI 资质的医院,行早期PCI 治疗。低危NSTE-ACS 患者可继续在基层医院接受抗栓及抗缺血治疗,进一步完善无创负荷试验(首选影像学检查,也可选心电图平板运动试验)评估是否存在可诱发的心肌缺血,对存在可诱发的心肌缺血患者进行有创性的冠状动脉造影检查。
3. 特殊ACS 患者:血流动力学不稳定是ACS 患者转运风险的主要危险因素。对于发生心脏骤停、恶性心律失常、急性心力衰竭、心源性休克的ACS 患者转运风险增加,但尽快行再灌注治疗的获益也最大。基层医院接诊这类患者,应首先对接胸痛中心网络,在上级医院网络会诊指导下进行初步抢救、血流动力学支持。经处理后再次评估患者生命特征、转运时患者可耐受时间及转运时程、救护车条件,并积极转运。选择具备抢救条件、配备高级心肺复苏训练医护人员的救护车进行转运。尽可能实施绕行非PCI 医院、绕行急诊室,以最大限度节省救治环节和时间。对于已实施长时间心肺复苏,但自主循环仍不能恢复的患者,则不建议转运。
参与共识制定的专家(按汉语拼音字母顺序排列):
陈步星(首都医科大学附属北京天坛医院,北京 100050),董鹏(中国医科大学航空总医院,北京 100012),高炜(北京大学第三医院,北京100191),黄进(南京市胸科医院,南京 210046),霍勇(北京大学第一医院,北京 100034),刘健(北京大学人民医院心内科,北京 100044),聂绍平(首都医科大学附属北京安贞医院,北京 100029),彭文辉(上海市第十人民医院,上海 200072), 钱菊英(复旦大学附属中山医院,上海200032),田野( 哈尔滨医科大学附属第一医院, 哈尔滨150001),肖国胜(厦门大学附属心血管病医院,厦门 361004),徐标(南京大学医学院附属鼓楼医院,南京 210008),杨丽霞(解放军联勤保障部队第九二〇医院,昆明 650032),颜红兵(中国医学科学院阜外心血管病医院,北京 100037),朱建华(浙江大学医学院附属第一医院,杭州 310003)
参考文献:略
文章来源:中华心血管病杂志(网络版)2019 年1 月第2 卷第1 期
www.ahyllaw.com、安徽医疗纠纷律师、合肥医疗纠纷律师、安徽医疗事故律师、合肥医疗事故律师、安徽医疗律师、合肥医疗律师、医疗事故律师、医疗纠纷律师


