中华医学会妇产科学分会产科学组
羊水栓塞(amniotic fluid embolism,AFE)是产科特有的罕见并发症,其临床特点为起病急骤、病情凶险、难以预测,可导致母儿残疾甚至死亡等严重的不良结局。中华医学会妇产科学分会产科学组结合国内外文献,参考美国母胎医学会(Society for Maternal-Fetal Medicine,SMFM)“AFE 指南”等,根据我国的临床实践制定了本共识,旨在提高及规范AFE诊断和抢救治疗能力,以改善孕产妇和围产儿结局。
一、AFE的流行病学及病理生理
全球范围内AFE的发生率和死亡率存在很大的差异,根据现有的文献,AFE的发生率为(1.9~7.7)/10万,死亡率为19%~86%。近年来,由于各医学学科的发展及支持治疗能力的提高,AFE孕产妇的死亡率已有明显的下降。
临床研究和动物实验的证据显示,在母体血循环中发现羊水的有形成分与AFE的发病并没有直接的联系。AFE的发病机制尚不明确。通常认为,当母胎屏障破坏时,羊水成分进入母体循环,一方面引起机械性的阻塞,另一方面母体将对胎儿抗原和羊水成分发生免疫反应,当胎儿的异体抗原激活母体的炎症介质时,发生炎症、免疫等“瀑布样”级联反应,从而发生类似全身炎症反应综合征,引起肺动脉高压、肺水肿、严重低氧血症、呼吸衰竭、循环衰竭、心脏骤停及孕产妇严重出血、DIC、多器官功能衰竭等一系列表现;在这个过程中,补体系统的活化可能发挥着重要的作用。
二、临床表现
AFE通常起病急骤。70%的AFE发生在产程中,11%发生在经阴道分娩后,19%发生于剖宫产术中及术后;通常在分娩过程中或产后立即发生,大多发生在胎儿娩出前2 h 及胎盘娩出后30 min内。有极少部分发生在中期妊娠引产、羊膜腔穿刺术中和外伤时。
AFE的典型临床表现为产时、产后出现突发的低氧血症、低血压和凝血功能障碍。
1. 前驱症状:30%~40%的AFE孕产妇会出现非特异性的前驱症状,主要表现为憋气、呛咳、呼吸急促、心慌、胸痛、寒颤、头晕、恶心、呕吐、乏力、麻木、针刺样感觉、焦虑、烦躁、精神状态的改变及濒死感等,临床上需重视这些前驱症状。
AFE如在胎儿娩出前发生,胎心电子监护可显示胎心减速、胎心基线变异消失等异常;严重的胎儿心动过缓可为AFE的首发表现。
2. 呼吸循环功能衰竭:孕产妇出现突发呼吸困难和(或)口唇发绀、血氧饱和度下降、肺底部较早出现湿啰音、插管者的呼气末二氧化碳分压测不出;心动过速、低血压休克、抽搐、意识丧失或昏迷、心电图可表现为右心负荷增加等。病情严重者,可出现心室颤动、无脉性室性心动过速及心脏骤停,于数分钟内猝死。
3. 凝血功能障碍:大部分AFE 孕产妇存在DIC,发生率高达83%以上,且可为AFE的首发表现。表现为胎儿娩出后无原因的、即刻大量产后出血,且为不凝血,以及全身皮肤黏膜出血、血尿、消化道出血、手术切口及静脉穿刺点出血等DIC表现。
4. 急性肾功能衰竭等多器官功能损害:AFE孕产妇的全身器官均可受损,除心、肺功能衰竭及凝血功能障碍外,肾脏和中枢神经系统是最常受损的器官和系统,存活的AFE孕产妇可出现肾功能衰竭和中枢神经系统功能受损等表现。
由于被累及的器官与系统不同,AFE的临床表现具有多样性和复杂性。
三、诊断
目前尚无国际统一的AFE诊断标准和有效的实验室诊断依据,建议的诊断标准如下。
1. 诊断AFE,需以下5条全部符合:
(1)急性发生的低血压或心脏骤停。
(2)急性低氧血症:呼吸困难、紫绀或呼吸停止。
(3)凝血功能障碍:有血管内凝血因子消耗或纤溶亢进的实验室证据,或临床上表现为严重的出血,但无其他可以解释的原因。
(4)上述症状发生在分娩、剖宫产术、刮宫术或是产后短时间内(多数发生在胎盘娩出后30 min内)。
(5)对于上述出现的症状和体征不能用其他疾病来解释。
2. 当其他原因不能解释的急性孕产妇心、肺功能衰竭伴以下1种或几种情况:低血压、心律失常、呼吸短促、抽搐、急性胎儿窘迫、心脏骤停、凝血功能障碍、孕产妇出血、前驱症状(乏力、麻木、烦躁、针刺感),可考虑为AFE。这不包括产后出血但没有早期凝血功能障碍证据者,或其他原因的心肺功能衰竭者。
AFE的诊断是临床诊断。符合AFE临床特点的孕产妇,可以做出AFE的诊断,母体血中找到胎儿或羊水成分不是诊断的必须依据。不具备AFE临床特点的病例,仅仅依据实验室检查不能做出AFE的诊断。孕产妇行尸体解剖,其肺小动脉内见胎儿鳞状上皮或毳毛可支持AFE的诊断。
血常规、凝血功能、血气分析、心电图、心肌酶谱、胸片、超声心动图、血栓弹力图、血流动力学监测等有助于AFE的诊断、病情监测及治疗。
四、鉴别诊断
AFE的诊断强调为细致、全面的排他性诊断。排除导致心力衰竭、呼吸衰竭、循环衰竭的疾病,包括肺栓塞、心肌梗死、心律失常、围产期心肌病、主动脉夹层、脑血管意外、药物性过敏反应、输血反应、麻醉并发症(全身麻醉或高位硬膜外阻滞)、子宫破裂、胎盘早剥、子痫、脓毒血症等。
AFE需特别注意与严重产后出血引起的凝血功能异常相鉴别。一旦产后很快发生阴道流血且为不凝血,或大量阴道流血及与出血量不符的血压下降或氧饱和度下降,应立即进行凝血功能的相关检查,如出现急性凝血功能障碍,特别是有低纤维蛋白原血症时,应高度怀疑AFE或者胎盘早剥。
在分娩过程中或产后出现心肺、凝血功能异常等表现时,在保证基本的呼吸循环支持治疗的同时,充分结合病史、发病特征及凝血功能等辅助检查结果,多数情况下做出正确的鉴别诊断并不困难,重要的是能考虑到AFE的诊断。
五、处理
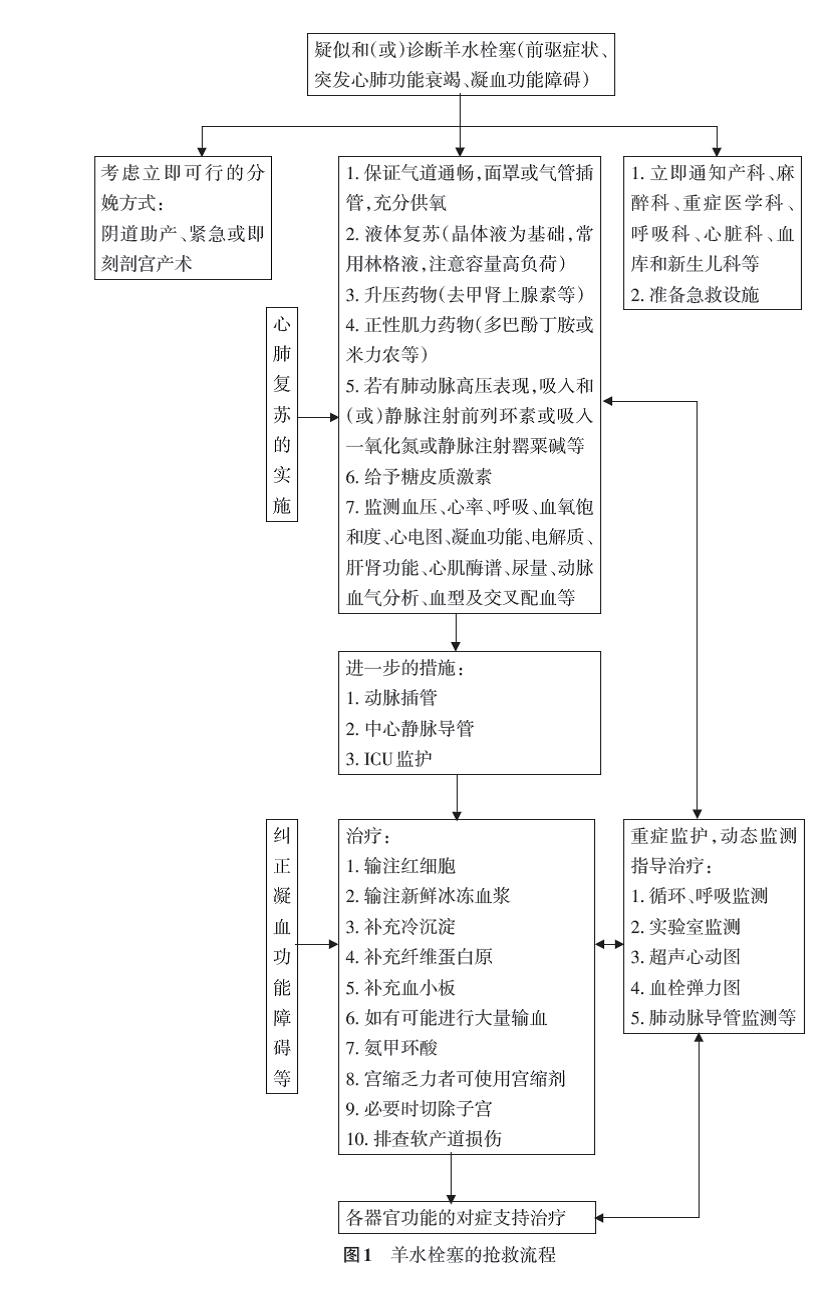
一旦怀疑AFE,立即按AFE急救。推荐多学科密切协作参与抢救处理,及时、有效的多学科合作对于孕产妇抢救成功及改善其预后至关重要。
AFE的治疗主要采取生命支持、对症治疗和保护器官功能,高质量的心肺复苏(CPR)和纠正DIC至为重要。
(一)呼吸支持治疗
立即保持气道通畅,充分给氧,尽早保持良好的通气状况是成功的关键,包括面罩给氧、无创面罩或气管插管辅助呼吸等。
(二)循环支持治疗
根据血流动力学状态,在AFE的初始治疗中使用血管活性药物和正性肌力药物,以保证心输出量和血压稳定,并应避免过度输液。
1. 液体复苏:以晶体液为基础,常用林格液。在循环支持治疗时一定要注意限制液体入量,否则很容易引发心力衰竭、肺水肿,且肺水肿也是治疗后期发生严重感染、脓毒血症的诱因之一。
2. 使用去甲肾上腺素和正性肌力药物等维持血流动力学稳定:AFE初始阶段主要表现为右心衰竭,心脏超声检查可提供有价值的信息。针对低血压,应使用去甲肾上腺素或血管加压素等药物维持血压,如去甲肾上腺素0.05~3.30μg·kg-1·min-1,静脉泵入。多巴酚丁胺、磷酸二酯酶抑制剂兼具强心和扩张肺动脉的作用,是治疗的首选药物,使用多巴酚丁胺2.5~5.0μg·kg-1·min-1,静脉泵入;磷酸二酯酶抑制剂(米力农)0.25~0.75μg·kg-1·min-1,静脉泵入。
3. 解除肺动脉高压:使用前列环素、西地那非、一氧化氮及内皮素受体拮抗剂等特异性舒张肺血管平滑肌的药物。前列环素即依前列醇(epoprostenol)10~50ng·kg-1·min-1,吸入;或伊洛前列素(iloprost)10~20μg/次,吸入,6~9次/d;或曲前列尼尔(treprostinil)1~2 ng·kg-1·min-1起始剂量,静脉泵入,逐步增加直至达到效果;西地那非20 mg/次,口服,3次/d,或通过鼻饲和(或)胃管给药;一氧化氮5~40 ppm,吸入。也可给予罂粟碱、阿托品、氨茶碱、酚妥拉明等药物。
4. 当孕产妇出现AFE相关的心脏骤停时,应首先、即刻进行标准的基础心脏生命支持(BCLS)和高级心脏生命支持(ACLS)等高质量的心肺复苏。
心脏骤停复苏初期不需要明确AFE的诊断,此时,最关键的紧急行动是高质量的心肺复苏。对未分娩的孕妇,应左倾30°平卧位或子宫左牵防止负重子宫压迫下腔静脉。
5. 应用糖皮质激素:糖皮质激素用于AFE的治疗存在争议。基于临床实践的经验,尽早使用大剂量糖皮质激素,应作为有益的尝试。氢化可的松500~1 000 mg/d,静脉滴注;或甲泼尼龙80~160 mg/d,静脉滴注;或地塞米松20 mg静脉推注,然后再予20 mg静脉滴注。
6. 新的循环支持策略:AFE发生后,对于血管活性药物无效的顽固性休克孕产妇,进行有创性血流动力学支持可能是有益的。体外膜肺氧合(ECMO)和主动脉内球囊反搏等策略已经在多个病例报道中被证明是有效的。因此,在初步复苏干预无反应的情况下,可考虑上述有创性支持方法。
(三)处理凝血功能障碍
凝血功能障碍可在AFE并发心血管系统异常后出现,也可为首发表现,推荐早期进行凝血状态的评估。AFE引发的产后出血、DIC往往较严重,应积极处理,快速补充红细胞和凝血因子(新鲜冰冻血浆、冷沉淀、纤维蛋白原、血小板等)至关重要,尤其需要注意补充纤维蛋白原。同时进行抗纤溶治疗,如静脉输注氨甲环酸等。如有条件,早期即按大量输血方案进行输血治疗可使抢救更有效;有条件者可使用床旁血栓弹力图指导血液成分的输注。
AFE常伴有宫缩乏力,需要积极治疗,必要时使用宫缩剂,例如缩宫素、麦角新碱和前列腺素。经阴道分娩者要注意检查是否存在子宫颈、阴道等产道裂伤。
临床上对于肝素治疗AFE引起的DIC的争议很大。由于AFE进展迅速,难以掌握何时是DIC的高凝阶段,使用肝素治疗弊大于利,因此不常规推荐肝素治疗,除非有早期高凝状态的依据。
(四)产科处理
若AFE发生在胎儿娩出前,抢救孕妇的同时应及时终止妊娠,行阴道助产或短时间内行剖宫产术。当孕产妇发生心脏骤停,胎儿已达妊娠23周以上,立即进行心肺复苏的同时准备紧急剖宫产术;如孕产妇心肺复苏4 min后仍无自主心率,可以考虑行紧急剖宫产术,这不仅可能会拯救胎儿的生命,而且在理论上可以通过去除孕产妇下腔静脉的压力从而有利于其复苏。但当AFE孕产妇发生心脏骤停时,在孕产妇围死亡期做出剖宫产术的决定是比较困难的,须根据抢救现场的具体情况做出决策,并无统一的处理标准。
子宫切除不是治疗AFE的必要措施,不应实施预防性子宫切除术。若产后出血难以控制,危及产妇生命时,果断、快速地切除子宫是必要的。
(五)迅速、全面的监测
立即进行严密的监护,全面的监测应贯穿于抢救过程的始终,包括血压、心率、呼吸、尿量、凝血功能、电解质、肝肾功能、血氧饱和度、心电图、动脉血气分析、中心静脉压、心输出量等。经孕产妇食管或胸超声心动图和肺动脉导管,可作为监测其血流动力学的有效手段。
(六)器官功能支持与保护
AFE急救成功后往往会发生急性肾功能衰竭、急性呼吸窘迫综合征、缺血缺氧性脑损伤等多器官功能衰竭及重症脓毒血症等。
心肺复苏后要给予适当的呼吸、循环等对症支持治疗,以继续维持孕产妇的生命体征和内环境稳定,包括神经系统保护、亚低温治疗、稳定血流动力学及足够的血氧饱和度、血糖水平的控制、血液透析和(或)滤过的应用、积极防治感染、胃肠功能的维护、微循环的监测与改善、免疫调节与抗氧化治疗等。
羊水栓塞临床诊断与处理专家共识(2018)的要点:
•羊水栓塞属临床诊断
•推荐多学科协作参与抢救处理,特别是有经验的麻醉科医师参与抢救
•高质量的心肺复苏至为重要。初始治疗主要是辅助呼吸和升压强心,应避免过度输液
•使用前列环素、西地那非等药物解除肺动脉高压,也可给予罂粟碱等
•基于临床实践经验,尽早使用大剂量糖皮质激素或有价值
•常出现凝血功能障碍,应及早评估凝血功能,积极纠正凝血功能紊乱。肝素治疗DIC 弊大于利,不常规推荐使用
•疑似和(或)诊断羊水栓塞,抢救的同时应尽快终止妊娠
•积极治疗宫缩乏力,必要时使用宫缩剂,例如缩宫素、麦角新碱和前列腺素等
•子宫切除不是治疗的必要措施,不应实施预防性切除。若产后出血危及产妇生命时,果断、快速地切除子宫是必要的
因为目前并无特异性的检查方法,所以AFE的诊断仍然是以临床表现为基础的排除性诊断。如果临床高度怀疑AFE,及早的治疗是有必要的。准确到位的日常急救演练是保证AFE抢救成功的关键。治疗主要是支持、对症治疗,包括呼吸支持(通常以气管插管和机械通气的形式)、适当补液的循环支持、血管活性药物、正性肌力药物、肺血管扩张剂、及时分娩及适时的子宫切除、积极处理凝血功能障碍以及器官功能的支持治疗与保护,而迅速、全面的监测是实施有效治疗措施的保证。AFE的抢救流程见图1。
本共识的执笔专家:古航(海军军医大学附属长海医院)、杨慧霞(北京大学第一医院)、王谢桐(山东省立医院)
参与本共识制定及讨论的专家:杨慧霞(北京大学第一医院)、段涛(上海市第一妇婴保健院)、刘兴会(四川大学华西第二医院)、胡娅莉(南京大学医学院附属鼓楼医院)、古航(海军军医大学附属长海医院)、王谢桐(山东省立医院)、陈敦金(广州医科大学第三附属医院)、漆洪波(重庆医科大学附属第一医院)、杨孜(北京大学第三医院)、李笑天(复旦大学附属妇产科医院)、郑勤田(广州市妇女儿童医疗中心)、李颖川(上海交通大学附属第六人民医院)、贺晶(浙江大学医学院附属妇产科医院)、张建平(中山大学孙逸仙医院)、林建华(上海交通大学医学院附属仁济医院)、丁依玲(中南大学湘雅二医院)、刘彩霞(中国医科大学附属盛京医院)、王子莲(中山大学附属第一医院)、苏放明(深圳市人民医院)、程蔚蔚(上海交通大学医学院附属国际和平妇婴保健院)、马润玫(昆明医科大学第一附属医院)、范玲(首都医科大学附属北京妇产医院)、蔺莉(首都医科大学附属北京友谊医院)、张卫社(中南大学湘雅医院)、樊尚荣(北京大学深圳医院)、马玉燕(山东大学齐鲁医院)、孙丽洲(南京医科大学第一附属医院)、罗国阳(美国霍华德大学医学院)、张为远(首都医科大学附属北京妇产医院)、陈叙(天津市中心妇产科医院)、刘俊涛(中国医学科学院北京协和医院)、时春艳(北京大学第一医院)、常青(陆军军医大学附属西南医院)、崔世红(郑州大学第三附属医院)、邹丽(华中科技大学同济医学院附属协和医院)、赵先兰(郑州大学第一附属医院)、肖梅(湖北省妇幼保健院)、徐先明(上海交通大学第一人民医院)、李力(陆军军医大学附属大坪医院)、刘喆(北京大学第一医院)
参考文献:略
文章来源:中华妇产科杂志2018 年12月第53 卷第12期
www.ahyllaw.com、安徽医疗纠纷律师、合肥医疗纠纷律师、安徽医疗事故律师、合肥医疗事故律师、安徽医疗律师、合肥医疗律师、医疗事故律师、医疗纠纷律师
“羊水栓塞临床诊断与处理专家共识( 2018) ”解读
林小凤 樊尚荣
羊水栓塞( amniotic fluid embolism,AFE) 是产科特有的罕见并发症,其临床特点为起病急骤、病情凶险、难以预测,可导致母儿残疾甚至死亡等严重的不良结局。中华医学会妇产科学分会产科学组结合国内外文献,参考美国母胎医学学会( Society for Maternal-Fetal Medicine,SMFM) “AFE 专家共识”等,根据我国的临床实践制定了“羊水栓塞临床诊断与处理专家共识( 2018) ”,旨在提高及规范AFE的诊断和治疗水平,以改善孕产妇与围产儿结局。
【解读】AFE 虽然罕见,但病死率高,诊断和治疗经验相当有限,及时正确诊治本病可改善母胎预后,对降低孕产妇死亡率有重要意义。本指南以美国母胎医学学会AFE 处理指南为主要文献,根据学组专家经验并参考相关文献制定,以期提高我国AFE 正确诊断率和救治成功率。
一、AFE 的流行病学及病理生理
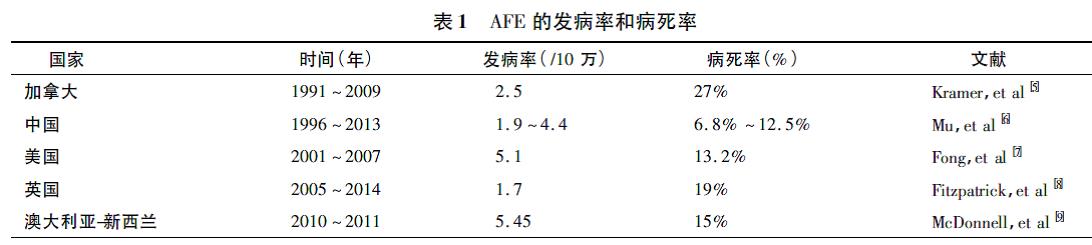
1.流行病学: 全球范围内AFE 的发生率和死亡率存在很大差异,其发生率为( 1.9~7.7)/10万,死亡率为19%~86%。
【解读】几个大样本研究和综述报道了全球部分国家AFE 的发病率和死亡率,不同国家、地区和不同诊断标准下,很难比较AFE 的发病率和死亡率,总体上,AFE 的死亡率在不断下降,见表1。
2. 病理生理: AFE 的发病机制尚不明确,目前认为当母胎屏障破坏时,羊水成分进入母体循环,胎儿的异体抗原激活母体的炎症介质时,发生炎症、免疫等“瀑布样”级联反应,从而发生类似全身炎症反应综合征,引起肺动脉高压、肺水肿、严重低氧血症、呼吸衰竭、循环衰竭、心脏骤停及孕产妇严重出血、弥散性血管内凝血( disseminated intravascular coagulation,DIC) 、多器官功能衰竭等; 在这个过程中,补体系统的活化可能发挥着重要的作用。
【解读】1941 年,病理学家Steiner 和Luschbaugh在对围产期突发死亡孕产妇尸检时,发现其血液循环中存在羊水有形成分,认为因“羊水肺栓塞”导致患者死亡,并将该病命名为AFE,但最近的研究否定了这种假设。羊水突破母胎屏障,由羊水胎儿成分引起炎症介质释放和反应,导致临床表现类似过敏或感染性休克样全身炎症反应综合征,曾有学者建议将“AFE”更名为“妊娠过敏样综合征”,但按过敏救治AFE 效果并不理想。目前认为,AFE更像羊水中抗原成分引起机体炎症介质释放引起的全身炎症反应,包括心肺衰竭和凝血功能障碍。羊水中的抗原激活孕妇体内的补体系统反应,并有临床研究证明补体抑制剂对患者有一定治疗作用。
二、临床表现多样性
70%的AFE 发生在产程中,11% 发生在经阴道分娩后,19% 发生于剖宫产术中及术后; 通常在分娩过程中或产后立即发生,大多发生在胎儿娩出前2 h 内及胎盘娩出后30 min 内。有极少部分发生在中期妊娠引产、羊膜腔穿刺术中和外伤时。AFE的典型临床表现为产时、产后出现突发的低氧血症、低血压和凝血功能障碍。
1.呼吸循环功能衰竭: 孕产妇出现突发呼吸困难和( 或) 口唇发绀、血氧饱和度下降、肺底部较早出现湿啰音、插管者的呼气末二氧化碳分压测不出; 心动过速、低血压休克、抽搐、意识丧失或昏迷,心电图可表现为右心负荷增加等。病情严重者,可出现心室颤动、无脉性室性心动过速及心脏骤停,于数分钟内猝死。
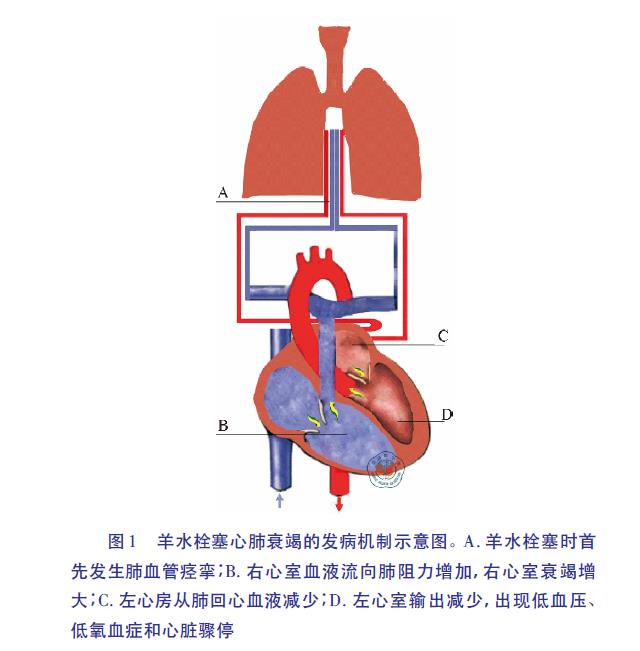
【解读】“突发”强调了AFE 引起的机体改变非常迅速,低氧血症、低血压和严重产后出血是典型AFE 的三联征。肺动脉高压是其主要原因。图1 为AFE 心肺衰竭的发病机制。
2.凝血功能障碍: DIC 发生率高达83% 以上,且可为AFE 的首发表现。表现为胎儿娩出后无原因的、即刻大量产后出血,且为不凝血,以及全身皮肤黏膜出血、血尿、消化道出血、手术切口及静脉穿刺点出血等表现。
【解读】凝血功能障碍是AFE 的特征性表现,有重要诊断价值。至少有2 个病例报道发现患者AFE 发病时通过超声心动图观察到右心室出现团块和在观察过程中消失。在高凝期,临床经常出现采集至试管的血液凝固或溶血而无法检测。
凝血功能异常的实验室检测异常包括: (1) 血小板<100×109/L 或进行性下降; (2) 凝血酶原时间>15s 或超过对照组3s 以上和部分凝血活酶时间延长; (3) 纤维蛋白原<1.5g/L; (4) 鱼精蛋白副凝[3P]试验阳性等。
3.其他器官功能损害: AFE 孕产妇的全身器官均可受损,除心、肺功能衰竭及凝血功能障碍外,肾脏和中枢神经系统是最常受损的器官和系统,存活的AFE 孕产妇可出现肾功能衰竭和中枢神经系统功能受损等表现。由于被累及的器官和系统不同,AFE 的临床表现具有多样性和复杂性。
【解读】由心脏骤停和DIC 导致器官严重缺氧,引起急性肾功能衰竭等多器官功能障碍综合征或多器官衰竭,受损或衰竭器官数与患者死亡率相关。
三、强调临床诊断
全部符合以下5 条可诊断AFE: (1) 急性发生的低血压或心脏骤停; (2) 急性低氧血症,呼吸困难、紫绀或呼吸停止; (3) 凝血功能障碍,血管内凝血因子消耗或纤溶亢进的实验室证据,或临床上表现为严重的出血,但无其他原因可以解释; (4) 上述症状发生在分娩、剖宫产术、刮宫术或是产后短时间内( 多数发生在胎盘娩出后30 min 内) ; (5) 对于上述出现的症状和体征不能用其他疾病来解释。
【解读】AFE 主要基于临床诊断和排除诊断。临床特征是分娩过程中或胎儿娩出后短时间内出现喘憋、血压下降、紫绀、心肺功能衰竭、心脏骤停,或由DIC 引起产后大出血且无其他原因可以解释。根据我国国情,共识同时提供了诊断非典型AFE 的标准。Clark 等2016 年提出了AFE相关DIC 的诊断标准: 根据血小板计数、纤维蛋白原、血浆凝血酶原时间或国际标准化比值评分≥3。
四、多学科团队处理
一旦怀疑AFE,立即按AFE 急救。推荐多学科密切协作参与抢救处理,及时、有效的多学科合作对于孕产妇抢救成功及改善其预后至关重要。
【解读】AFE 时病情发展迅速,严重时迅速出现呼吸和心脏衰竭并大出血,医院需建立AFE 应急团队及制定和实施相应应急预案,并常规进行培训、模拟演练和案例评审。
AFE 的治疗主要采取生命支持、对症治疗和器官功能保护,高质量的心肺复苏和纠正DIC 至为重要。
(一) 呼吸支持治疗
立即保持气道通畅,充分给氧,尽早保持良好的通气状况是成功的关键,包括面罩给氧、无创面罩或气管插管辅助呼吸等。
【解读】呼吸支持的目的是纠正和预防缺氧,如果不能及时纠正缺氧,可随时发生心脏骤停。对呼吸困难与面色青紫的患者,立即给予呼气末正压给氧,鼻导管给氧效果不佳,至少用面罩给氧。正压给氧效果不好或意识丧失者,尽早行气管插管或气管切开,有条件时尽早使用呼吸机,尽量保持血氧饱和度在90% 以上。需要充分评估孕产妇气管插管的困难程度,在高级气道放置期间应尽量避免中断胸外按压以防止缺氧。
(二) 循环支持治疗
根据血流动力学状态,在AFE 的初始治疗中使用血管活性药物和正性肌力药物,以保证心输出量和血压稳定,并应避免过度输液。
1.液体复苏: 以晶体液为基础,常用林格液。在循环支持治疗时一定要注意限制液体入量,否则很容易引发心力衰竭、肺水肿,且肺水肿也是治疗后期发生严重感染、脓毒症的诱因之一。
【解读】AFE 的休克主要为肺血管痉挛所致右心衰及随后发生的全心衰,导致血液不能从右心回到左心及左心衰竭是休克的根本原因,液体复苏强调适量补液,过量输液可引起急性肺水肿。
2.使用去甲肾上腺素和正性肌力等药物维持血流动力学稳定: AFE 初始阶段主要表现为右心衰竭,心脏超声检查可提供有价值的信息。针对低血压,应使用去甲肾上腺素或血管加压素等药物维持血压,如去甲肾上腺素0. 05~3.30μg/( kg·min) ,静脉泵入。多巴酚丁胺、磷酸二酯酶抑制剂兼具强心和扩张肺动脉的作用,是首选的治疗药物,使用多巴酚丁胺2.5~5.0μg/(kg·min) ,静脉泵入; 磷酸二酯酶抑制剂( 米力农) 0.25~0.75μg/( kg·min) ,静脉泵入。
【解读】如果患者低血压很严重或补液后血压仍未能恢复,必须应用有效的血管活性药物治疗。当右心衰竭时,有效解除肺血管痉挛是治疗的关键。针对右心功能不全的治疗药物包括西地那非、多巴酚丁胺和米力农。
3.解除肺动脉高压: 使用前列环素、西地那非、一氧化氮及内皮素受体拮抗剂等特异性舒张肺血管平滑肌的药物。前列环素即依前列醇( epoprostenol)10~50ng/(kg·min) ,吸入; 或伊洛前列素( iloprost)10~20μg/次,吸入,6~9次/d; 或曲前列尼尔( treprostinil) 1~2 ng /( kg·min) 起始剂量,静脉泵入,逐步增加直至达到效果; 西地那非20 mg/次,口服,3次/d,或通过鼻饲和(或) 胃管给药; 一氧化氮5~40 ppm,吸入。也可给予罂粟碱、阿托品、氨茶碱、酚妥拉明等药物。
【解读】AFE 过程仅存在暂时肺动脉高压,在心脏衰竭时,肺动脉压同时降低,此时并无肺动脉高压。相关药物的主要作用在于解除肺血管痉挛。有几种前列环素拟似物已应用于肺动脉高压治疗,包括依前列醇、伊洛前列素、曲前列环素和贝前列素等。其他传统解除肺血管痉挛药物包括盐酸罂粟碱、氨茶碱、阿托品和酚妥拉明的作用非常有限,基本不再推荐应用。
4.当孕产妇出现AFE 相关的心脏骤停时,应即刻进行标准的基础心脏生命支持和高级心脏生命支持等高质量的心肺复苏。心脏骤停复苏初期不需要明确AFE 的诊断,此时,最关键的紧急行动是高质量的心肺复苏。对未分娩的孕妇,应左倾30°平卧位或子宫左牵防止负重子宫压迫下腔静脉。
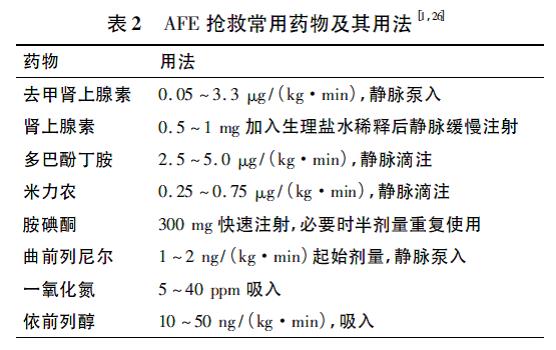
【解读】积极有效心肺复苏和正确产科处理是成功抢救的关键。AFE 患者如果不能及时纠正心脏衰竭,持续低血压的后果必然是心脏骤停。如果血压不能维持,需要在心脏骤停前考虑应用作用更强的血管活性药物如肾上腺素提升血压,在心肺复苏过程中,维持血压也同样重要,肾上腺素、去甲肾上腺素及去氧肾上腺素等均可用于提升和维持血压。其他救治要点包括及时气管插管,有效胸外按压,对有指征患者及时除颤。AFE 抢救药物和用法见表2。
5.应用糖皮质激素: 糖皮质激素用于AFE 的治疗存在争议。基于临床实践的经验,尽早使用大剂量糖皮质激素,应作为有益的尝试。氢化可的松500~1000mg/d,静脉滴注; 或甲泼尼龙80~160mg/d,静脉滴注; 或地塞米松20 mg 静脉推注,然后再予20mg 静脉滴注。
【解读】尚无证据表明应用大剂量肾上腺皮质激素抗过敏治疗可改善孕产妇及胎儿预后。SMFM 指南没有推荐应用肾上腺皮质激素。高剂量的肾上腺皮质激素可能对AFE 治疗有效,可选用氢化可的松或地塞米松静脉注射或滴注。
6.新的循环支持策略: AFE 发生后,对于血管活性药物无效的顽固性休克孕产妇,进行有创性血流动力学支持可能是有益的。体外膜肺氧合(extracorporeal membrane oxygenation,ECMO) 和主动脉内球囊反搏等策略已经在多个病例报道中被证明是有效的。因此,在初步复苏干预无反应的情况下,可考虑上述有创性支持治疗方法。
【解读】有多个报道应用ECMO 抢救AFE 患者获得成功,有条件者可尝试。
(三) 处理凝血功能障碍
AFE 引发的产后出血、DIC 往往较严重,应积极处理,快速补充红细胞和凝血因子( 新鲜冰冻血浆、冷沉淀、纤维蛋白原、血小板等) 至关重要,尤其需要注意补充纤维蛋白原。同时进行抗纤溶治疗,如静脉输注氨甲环酸等。如有条件,早期即按大量输血方案进行输血治疗可使抢救更有效; 有条件者可使用床旁血栓弹力图指导血液成分的输注。
【解读】根据临床表现和实验室检查评估凝血状态,一旦诊断凝血功能障碍,应迅速补充相应凝血因子。补充目标是维持凝血酶原时间及活化凝血酶原时间< 1.5 倍平均值,并维持纤维蛋白原水平在1g/L 以上。同时补充红细胞。大量输血方案不完全适合救治AFE,患者需要的凝血因子输注可能更多。应用适量抗纤溶药物如氨甲环酸是有益的,推荐1 次剂量为1g 氨甲环酸静脉缓慢输注,1 d 用量0.75~2.00g。在药物和手术治疗都无法有效止血且出血量较大并存在凝血功能障碍的情况下,有条件的医院还可考虑使用重组活化Ⅶ因子( rFⅦa) 作为辅助治疗的方法,应用剂量为90μg/kg,可在15~30 min 内重复给药。
AFE 常伴有宫缩乏力,需要积极治疗,必要时使用宫缩剂,例如缩宫素、麦角新碱和前列腺素。
经阴道分娩者要注意检查是否存在子宫颈、阴道等产道裂伤。
【解读】宫缩乏力和软产道损伤是产后出血的重要原因,其中以宫缩乏力最常见。AFE 救治过程中可以应用宫缩剂,软产道损伤出血可能是出血的原因和后果,凝血功能障碍加重出血,需要注意检查发现软产道损伤并及时缝合,需要预防、及时发现和处理血肿。宫腔填塞、B-Lynch 缝合及子宫切除均可用于治疗AFE 相关产后出血。
临床上对于肝素治疗AFE 引起DIC 的争议很大。由于AFE 进展迅速,难以掌握何时是DIC 的高凝阶段,使用肝素治疗弊大于利,因此不常规推荐肝素治疗,除非有早期高凝状态的依据。
【解读】AFE 所致DIC 同样分为高凝期、消耗性低凝期和继发性纤溶亢进期,临床上发现高凝期的机会较少,常常失去应用肝素的机会。诊断和治疗指南及多数专家意见均没有推荐在抢救AFE时应用肝素,至少不是抢救AFE 的主要措施。在高凝期AFE 病例可以应用肝素,但出血期应避免使用。
(四) 产科处理
若AFE 发生在胎儿娩出前,抢救孕妇的同时应及时终止妊娠,阴道助产或短时间内行剖宫产术。
当孕产妇发生心脏骤停,胎儿已达妊娠23 周以上,立即进行心肺复苏的同时准备紧急剖宫产术; 如孕产妇心肺复苏4 min 后仍无自主心率,可以考虑行紧急剖宫产术,这不仅可能拯救胎儿的生命,而且可以通过去除孕产妇下腔静脉的压力而有利于其复苏。但当AFE 孕产妇发生心脏骤停时,在孕产妇围死亡期做出剖宫产术的决定是比较困难的,须根据抢救现场的具体情况做出决策,目前尚无统一的处理标准。
子宫切除不是治疗AFE 的必要措施,不应实施预防性子宫切除术。若产后出血难以控制,危及产妇生命时,果断、快速地切除子宫是必要的。
【解读】大多数AFE 病例发生在分娩过程,终止妊娠的目的在于去除诱因和改善抢救条件,对胎儿已达到23 周者,还应考虑救治胎儿生命。如果宫口已开全,对有阴道助产条件者应立即行阴道助产,包括产钳、胎头吸引等,否则选择剖宫产。心脏骤停至分娩时间越短,预后越好。对手术的建议: (1) 院内心脏骤停者不建议转运孕妇; (2) 无须等待完整手术器械,有手术刀即可开始手术; (3) 简单消毒; (4) 胎儿娩出前保持子宫左侧位。若能在5 min 内娩出胎儿,可减少因缺血缺氧导致的新生儿不良结局。Rose 等报道18 例频死期剖宫产,12 例( 67%) 在剖宫产后患者心跳恢复。
(五) 迅速全面地监测
立即进行严密的监护,全面的监测应贯穿于抢救过程的始终,包括血压、心率、呼吸、尿量、凝血功能、电解质、肝肾功能、血氧饱和度、心电图、动脉血气分析、中心静脉压、心输出量等。经孕产妇食管或超声心动图和肺动脉导管,可作为监测其血流动力学的有效手段。
【解读】在AFE 救治过程中全面监测对救治和诊断都有重要意义,有条件者对患者经食道超声心动图和应用肺动脉导管监测患者血流动力学。
这些监测结果对重新认识AFE 发病机制、不断改进治疗方法和提高治疗水平有重要意义。
(六) 器官功能支持与保护策略
AFE 急救成功后往往会发生急性肾功能衰竭、急性呼吸窘迫综合征、缺血缺氧性脑损伤等多器官功能衰竭及重症脓毒症等。心肺复苏后要给予适当的呼吸和循环等对症支持治疗,以继续维持孕产妇的生命体征和内环境稳定,包括神经系统保护、亚低温治疗、稳定血流动力学及足够的血氧饱和度,血糖水平的控制、血液透析和( 或) 滤过的应用、积极防治感染、胃肠功能的维护、微循环的监测及免疫调节与抗氧化治疗等。
【解读】在心脏骤停后,由于缺氧可能导致多器官损伤或衰竭,脑组织对缺氧最敏感,常常形成不可逆损害。保护器官功能贯穿整个救治过程,包括应用冰帽保护脑组织; 多器官损伤或衰竭需要转诊到有救治经验的机构救治。
因为目前并无特异性的检查方法,所以AFE 的诊断仍然是以临床表现为基础的排除性诊断。如果临床高度怀疑AFE,及早治疗是有必要的。准确到位的日常急救演练是保证AFE 抢救成功的关键。
治疗原则主要是支持、对症治疗,包括呼吸支持( 通常以气管插管和机械通气的形式) 、适当补液的循环支持、血管活性药物、正性肌力药物、肺血管扩张剂、及时分娩及适时的子宫切除、积极处理凝血功能障碍以及器官功能的支持治疗与保护,而迅速、全面的监测是实施有效治疗措施的保证。
【解读】共识总结部分继续强调AFE 主要根据临床诊断和排除诊断,支持和对症治疗,强调由多学科救治。由于AFE 罕见和死亡率高,需要做好救治预案和进行模拟培训,提高救治成功率。共识提供了AFE 的抢救流程和共识要点,抢救流程可以制作成单页悬挂在产房。AFE 救治的关键流程见图2。

参考文献:略
文章来源:中华产科急救电子杂志2019 年2 月第8 卷第1 期


